更新 2024-2-24
アルカリ電池(Alkaline battery)とマンガン電池(Zinc-carbon battery)
日常生活で最もよく見かける電池といえば乾電池でしょう.
リチウムイオン電池は有用ですが、充電する関係上あまり実物を目にする機会はありません.乾電池は自分で取り替える必要があり、買い溜めの機会も多いことから見かける機会も多くなります.

昭和・平成・令和と時代が変わるごとに、市販される乾電池の種類も変わっていきました.かつてはマンガン電池が主でしたが、いつしかアルカリ電池が主流になりました.
マンガン電池はすぐに電源が切れますが、アルカリ電池はマンガン電池の数倍の寿命があります.現在ではマンガン電池は殆ど見られず、完全にアルカリ電池に置き換わっています.
さて、マンガン電池とアルカリ電池の違いは何でしょうか.
名前に共通点がないので別物と思われがちですが、実はこの2つの電池の電極材料や放電の機構はほとんど変わりません.両者とも亜鉛と酸化マンガンを用い、起電力も殆ど同じです.では、どうしてアルカリ電池が勝利をつかんだのでしょう.
今回は、19世紀中盤のルクランシェ電池の発明から続く、マンガン電池の系譜について見ていきます.
- アルカリ電池(Alkaline battery)とマンガン電池(Zinc-carbon battery)
- マンガン電池のはじまり
- ルクランシェ電池からマンガン電池へ
- マンガン電池からアルカリ電池へ
- まとめ
- 参考文献
マンガン電池のはじまり
そもそもなぜ「乾電池」と呼ぶのかといえば、構成物質が全て「乾いて」いるからです.
乾電池では、電解液の代わりに電解液を染み込ませたペーストを使用するか、あるいは完全に固体の電解質を使用します.(現在の乾電池は前者のものがほとんどです.そのため、乾電池とはいえど液漏れの可能性があります.)
最初期の電池であるボルタ電池やダニエル電池はいずれも電解質に水溶液を用いていることから、「湿った」電池です.ダニエル電池は広く使用されましたが、水溶液を用いるのでは持ち運びに不便です.なんとか「乾いた」電池を作りたいという需要は当時からあったと推測されます.

さて、ダニエル電池には水溶液を用いること以外にもいくつか難点がありました.その一つが「放電によって水溶液濃度が変わるので、起電力が低下しやすい」ことです.
アノードでは亜鉛イオン()濃度が増え、カソードでは銅イオン(
)濃度が減っていくので、起電力が低下しやすいのでした.
当時、電池の改良のために多くの試行がなされました.まだ電池の原理も完全には理解されていない時期でしたから、電池の構成要素として、身近な物質を多く試していたのだと推測されます.
1866年、フランスのGeorges Leclanchéによって発明された電池(ルクランシェ電池)は、やはり「湿った」電池ではあるものの、ダニエル電池の欠点をいくらか解消したものでした.
ルクランシェ電池(Leclanché cell)
ルクランシェ電池は、亜鉛()と酸化マンガン(
)の電極を多孔質材料で包み、塩化アンモニウム溶液の入った瓶に浸した構造を持つ電池です.電気伝導性を上げるために黒鉛を酸化マンガンと混合しています.この場合、負極が亜鉛、正極が酸化マンガン、電解液が塩化アンモニウムとなります.
各電極では、以下のような反応が起こります.
電解液の塩化アンモニウムをあらわに書けば、以下のようにも表せます.
(全体)
これらの反応により、ボルタ電池を超える 1.5 V 程度の起電力が得られます.
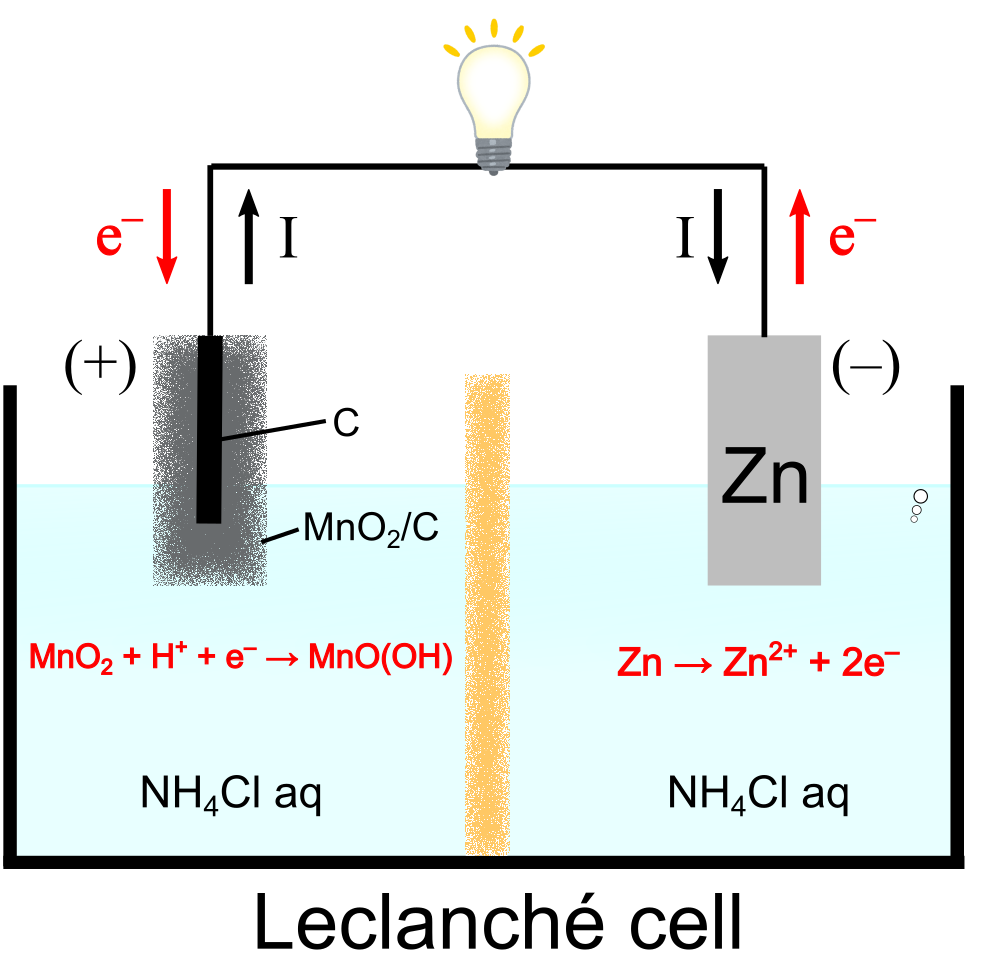
ルクランシェ電池は、一見ダニエル電池と同様の弱点を抱えているように見えます.すなわち、反応によって水溶液中のが増えると同時に
が減ることによって、反応に必要な材料が時間進行に従って減っていきます.
しかし、電解液では以下のような反応も同時に起こります.
この反応により、溶液の過剰な亜鉛イオンが沈殿するとともに正極反応に必要なを供給することができ、電解質のイオン濃度の変化が抑制され、放電による起電力低下を小さくすることができます.
結果として、ルクランシェ電池は工業的に広く利用されることとなりました.
ルクランシェ電池からマンガン電池へ
ルクランシェ電池は成功を収めましたが、欠点はまだありました.
前述の通りルクランシェ電池は、電解液として水溶液を用いる「湿った」電池です.これを「乾いた」電池へと変貌させた発明こそがマンガン電池(Zinc–carbon battery)であり、世界初の乾電池の発見でもありました.
「乾いた」電池を作り出すための手段は驚くほどシンプルです.
水溶液は持ち運びにくくて不便であるので、液を石膏に染み込ませることでペースト状にすることに成功しました.1876年、Carl Gassner はペーストを電解質として用いた「乾」電池の特許を取得しました.
なお、日本でも屋井先蔵が乾電池の開発に成功しています.屋井氏の乾電池は1893年のシカゴ万国博覧会に持ち込まれて注目を集めましたが、屋井氏自身は特許を取得する費用が用意できず、貧困に苦しみました.乾電池の価値が日本では殆ど理解されなかったことも一因なようです.
ともかく、これがマンガン電池の始まりです.これまでの湿電池に対して、マンガン電池は固く、メンテナンスが不要で、こぼれないといった利点がありました.
日本語では正極の酸化マンガンに注目してマンガン電池と呼ぶのに対し、英語圏では負極の亜鉛に注目したZinc–carbon battery(亜鉛・黒鉛電池)と呼ばれます.黒鉛は電気伝導性を上げるために使用されています.
水溶液の代わりにペーストを用いただけなので、マンガン電池の反応式はルクランシェ電池のものとほとんど変わりません.起電力も当然同じで1.5 Vです.
1880年頃には、ついに持ち運び可能な乾電池が開発されました.その後、100年近くにわたって、亜鉛、黒鉛、二酸化マンガンなどの主要構成要素は変わっていません.
一方で、要所要所に改善が加えられ、少しずつ特性が向上しています.
例えば、二酸化マンガンは天然産のものから電気分解で合成されたものが使用されるようになり、黒鉛もアセチレンブラックに、亜鉛も亜鉛合金に代わり、 電池が長寿命化しました.また、電解質も塩化アンモニウムから塩化亜鉛主体のものに変化しました.
マンガン電池からアルカリ電池へ
高性能化が進んだマンガン電池でしたが、依然として保存性や自己放電に関する問題は残されたままでした.マンガン電池はさらにもう一段の進化に成功し、アルカリ電池が誕生します.
マンガン電池からアルカリ電池への変化は、化学的には些細な変化です.
これまでのルクランシェ電池、マンガン電池は電解液に酸性溶液を使用していました.
アルカリ電池では、代わってアルカリ性(塩基性)の溶液(水酸化カリウム)を使用しているという特徴があります.
さて、これで何が変わるのでしょうか.
ともあれ、アルカリ電池の反応式を見てみましょう.
何が画期的か分かるでしょうか.
マンガン電池では、「反応によって水溶液中のイオンが増えると同時に
が減ること」が起こっていました.
一方、アルカリ電池ではこのように反応物を消費したり生成したりしません.負極で生成した水をそのまま正極で消費できるので、正味の物質変化がゼロになります.このため、アルカリ電池はマンガン電池と同じ電圧を持ちながらも、保存性が非常に良いという特徴があります.
現在、日本で生産される一次電池の半分近くがアルカリ電池で、懐中電灯や玩具、リモコン、時計などに使用されています.リチウムイオン電池の市場が大きくなっているとはいえ、アルカリ電池は安価であることから需要は根強くあります.
なお、化学的にはアルカリ電池の充電も可能ですが、市販のアルカリ電池は充電可能なようには設計されておらず、絶対に充電を試みてはいけません.とはいえ、近年では内部設計を工夫することで、充電が可能なアルカリ電池も登場しています.
まとめ
ルクランシェ電池を端緒とするマンガン電池の進化は、アルカリ電池の開発によって最盛期を迎えました.現在では、自宅にアルカリ電池の無い人はいないのではないかと思えるほど普及しています.リチウムイオン電池をはじめ、より高性能な電池は開発されていますが、アルカリ電池はコストパフォーマンスに優れることから、しばらくは天下が続きそうです.
なお、以上のアルカリ電池の歴史を見ると、反応式などは対して変化していないように見えます.しかし、電池というものは反応式を見出してからが非常に長く、副反応や毒性、耐久性、価格、自己放電性など多種多様なパラメータを全て満足した上で完成となります.
電池のメカニズムにはまだ分かっていないことも多く、どうしても試行錯誤に頼らなければならない面があります.負極、正極、電解液を開発した時点でやっとスタート地点です.電子機器の発達の中で、電池の開発にムーアの法則は適用できないのです.
現在ある電池は、多大なる努力と屍の上に立つ存在であることを忘れないようにしたいところです.
参考文献
化学と教育 2008 年 56 巻 3 号 p. 104-109
化学教育 1986 年 34 巻 1 号 p. 5-8