更新 2024-2-23
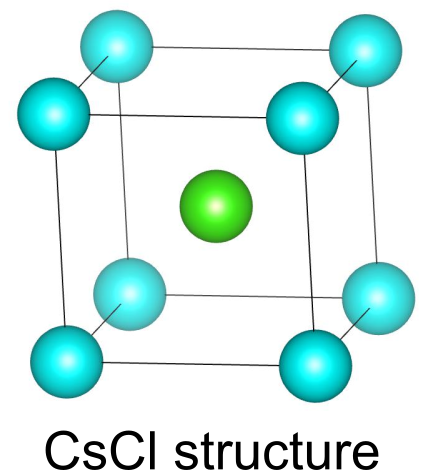
塩化セシウム型構造(塩化セシウム構造、CsCl型構造、CsCl-type structure)
塩化セシウム()型構造は、
の組成で表される二元系物質の多くに見られる結晶構造です.体心立方構造に似ていますが、よく見ると立方体の角にある原子と中心にある原子が異なります.
単位胞にはと
がそれぞれ1つずつ含まれています.
は8つの
に配位され、
も8つの
に配位されています.
この結晶構造を2種類の方法で見ていきます.
単純格子を基準とする方法
塩化セシウム型構造においてと
は等価です.
だけを見ると、立方体の角だけに原子が存在しているような単純立方構造です.
この中心(体心)にを入れ込むことで、塩化セシウム型構造が得られます.
を中心にしても良く、
の単純立方構造の体心に
があると考えても同様です.
立方体の体心なので、も
もそれぞれ8つの原子に配位されています.
と
の単純立方構造を (1/2, 1/2, 1/2) だけずらして配置した構造であるとも言えます.

多面体を基準にする方法

塩化セシウム型構造を持つ物質
塩化セシウム()型構造は塩化ナトリウム型構造と同じ組成を持ちますが、前者ではイオンが異符号のイオンに8配位され、後者では6配位されています.
型構造は配位数が多く、同符号のイオン間の距離が遠いため静電エネルギー的な安定性が高いです.
一般に2種類のイオンのイオン半径が近い場合に型構造が安定化します.しかし、イオン半径比に差があると同符号のイオンが接触しやすくなり、配位数の小さい別の構造(
型や
型)をとりやすくなります.
また、高圧条件では原子の配位数が多くなることが知られており、型の物質に高い圧力を変えると
型になる場合が多くあります(B1-B2転移).
型構造は一見、体心立方構造に見えますがそうではありません.体心立方構造になるために必要なことは、単位胞の立方体の角と中心に同じ原子があることです.
型構造では両者は異なるため、体心立方構造ではなく単純立方構造となります.
型構造を持つ物質はイオン結合性の絶縁体が主ですが、金属間化合物においても知られています.
代表的な物質
CsCl
塩化セシウム自体は無色透明・水溶性の絶縁体です.様々な種類のDNAや分子を分離するための遠心分離法に使用される他、放射性塩化セシウムを利用した放射線療法にも使用されています.また、非常に低い熱伝導率を示すことが発見されています.[a]
CsAu
金は反応性の低い元素として知られていますが、特殊な条件では陰イオンとなることができます.は陰イオン性の
を含む化合物です.[b]
FeRh
イオン結合性でない合金化合物であっても型構造をとる物質もあります.
は反強磁性から強磁性に転移する珍しい材料であり、磁気抵抗デバイスや反強磁性メモリ材料としての応用が期待されています.[c]
塩化セシウム型構造から派生する構造
型構造は2種類の原子によって構成されます.
サイト(
サイト)を別の構造ユニットに変えたり、間隙に別の原子を入れることにより新しい結晶構造が得られます.

体心立方構造(BCC)
型構造で2種類の原子が占有しているサイトを、いずれも1種類の原子で置き換えた場合には体心立方構造となります.
蛍石型構造
型構造の
サイトの半分を取り除くことにより、蛍石(
)型構造となります.蛍石型構造については別ページを参照.
Fe3Al型構造
型構造の
サイトの半分を
に置き換えることにより、
型構造が得られます.同構造を持つ
と
は最近、優れた熱電変換性能を示すことが発見されました.[d]
CaB6型構造
原子サイトの一方をからなる八面体で置き換えた構造です.
は耐火材料、
はトポロジカル絶縁体として知られています.
充填スクッテルダイト型構造
型構造の単位胞を8つ取り出し、8つの
サイトのうち6つを
からなる正方形に置き換えることで充填スクッテルダイト型構造が得られます.この構造を持つ物質は高い熱電変換性能を示すとともに、超伝導体としても知られています.
まとめ
型構造は、2つの単純立方格子を組み合わせることによって出来上がる非常にシンプルな結晶構造です.2種類のイオンのイオン半径が比較的近い場合に生成し、イオン結合性かつ絶縁体の物質が比較的よく見られます.教科書に必ず載っている代表的な結晶構造ではありますが、どちらかといえば地味な存在で、教科書以外でみかけることはさほど多くありません.
参考文献
U. Müller, Inorganic Structural Chemistry (Wiley, 2007).
[a] Angewandte Chemie, 2017, 129.13: 3679-3683.
[b] Chemical Society Reviews, 2008, 37.9: 1826-1835.
[c] Nature materials, 2014, 13.4: 367-374.
[d] Nature, 2020, 581.7806: 53-57.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).