更新 2024-2-29
水素吸蔵合金(Hydrogen absorbing alloy)
水を原料とする水素エネルギーは究極的にクリーンなエネルギーです.水素を燃焼しても水が放出されるのみで、地球温暖化の原因とされる二酸化炭素や環境問題で取り沙汰される窒素酸化物や硫黄酸化物が放出されません.
水素は燃焼させることで熱エネルギーに、内燃機関を用いることにより機械エネルギーに、燃料電池を用いて酸素と反応させることで電気エネルギーにそれぞれ変換することができます.

原料となる水も取り扱いが容易であり、安全性には疑いようがありません.ところが、水を水素に変換する反応は一筋縄ではいかない困難さを持っており、化石資源を利用した水蒸気改質反応により水素を生産しているのが現状です.
まあ、水素の生産はそのうち効率的な方法が見つかることを期待するとして、いざ水素を大量に生産したときのことを考えましょう.水素をどうやって保管すればいいのでしょうか.
水素の保管をどうする?
水素は常温常圧で気体であり、適当な容器に入れて保存・運搬するわけにはいかず何らかの工夫が必要です.水素を固体にすることができれば最も安全かつ効率的ですが、水素が凝固するには極低温で数百万気圧の条件が必要であり、残念ながらそのような条件に耐えられるボンベがありません.
仕方ないので、高圧ガスの状態で保存(高圧水素ガス)するか、液化させて保存(液体水素)します.

高圧水素ガスは、その名の通り高圧ボンベの中に封入して使用します.最も一般的な水素の保存方法ですが、高圧であるため十分な強度のボンベが必要であり、当然ながら十分な強度のボンベは重くなります.いざ何かの弾みでボンベが圧力に耐えられなくなった際に爆発のおそれがあるのも怖い点です.
液体水素は気体水素に比べて体積を小さくすることができ、単位体積あたりの水素量に優れます.しかし、水素の液化には極低温(-253℃)が必要であり、常温で少しずつ液体から気化してしまう水素(ボイルオフガス)を抑制する必要があります.
水素貯蔵の他の選択肢は、何らかの物質に水素を吸蔵させる方法です.
水素貯蔵材料では、水素分子が水素原子に解離して結晶格子間に侵入あるいは周辺元素との化学結合することにより水素化物を形成し、高密度で水素を吸蔵することができます.液体・気体での水素貯蔵よりも安全性に優れることと、必ずしも高圧を必要としないことが魅力です.
中でも水素吸蔵合金は、その名の通り水素の吸蔵が可能な合金材料であり、輸送・貯蔵の簡易さから注目を集めています.材料によっては、自身の体積の1000倍もの水素を吸うことができます.
水素吸蔵合金の仕組み
水素は最も単純な構造をした元素であり、ほとんどの元素と反応して水素化物を形成します.特に、一部の金属元素は容易に水素と反応して水素化物を作ります.
例として、での反応過程を見てみましょう.
は面心立方格子の金属であり、水素は八面体のすきま(間隙)に入ります.全ての八面体間隙に水素が入ると組成比は
になり、塩化ナトリウム型の水素化物
となります.
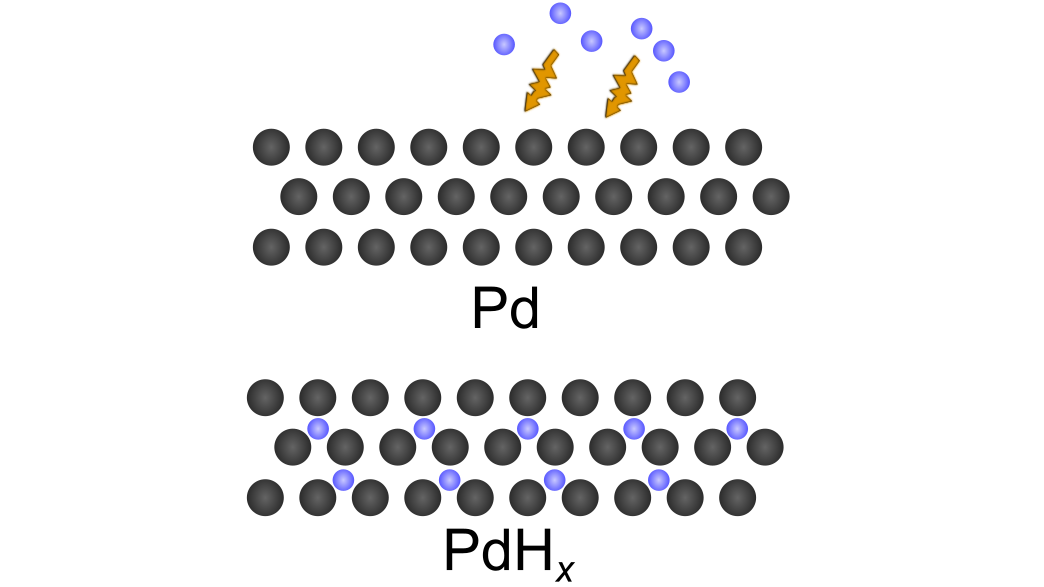
金属によって水素の入る間隙は異なり、最終的な組成もなどのバリエーションがあります.
水素吸蔵合金に求められること
当然、水素が入れば入るだけ好ましいですが、それだけでは実用材料とはなりません.水素吸蔵合金に求められる性質には以下のようなものがあります.
- 水素の吸収が容易であること
- 水素の放出が容易であること
- 水素の吸蔵量が多いこと
- 安全性が高いこと
すなわち、吸収しやすいだけでは水素の永久保存用にしか使えないので、必要なときに必要な分だけ水素を放出できるような性質が求められます.
や
などの金属は水素の吸収こそ容易なものの、一度水素を吸うとなかなか手放そうとせず、水素の放出に高温を必要とします.一方、
は水素と反応しにくく、水素化物の形成に高温・高圧の条件が必要になります.
金属元素の水素を吸収する能力は、水素化物を形成する際の生成エネルギーで定量化することが可能です.
ここで、は金属が取り込むことの可能な水素量です.
が負であれば発熱反応で反応が自発的に進み、正であれば吸熱反応で反応に余分なエネルギーが必要になります.
アルカリ金属、アルカリ土類金属、早期遷移金属(など)、希土類金属、そして
は水素との反応性が高いです.一方で、
以外の後期遷移金属(
など)は水素との反応を好みません.
水素吸蔵合金と呼ばれる材料は、「水素と反応しやすい金属」と「水素と反応しにくい金属」を組み合わせた合金であり、全体として水素化反応がわずかに発熱的なものとなっています.
こうすることにより、水素の吸収・放出反応を適切な温度・圧力条件に調整することが可能です.代表的な水素吸蔵合金であるをはじめ、
、
などの材料もこのような元素の組み合わせになっています.
水素吸蔵合金の評価方法
水素吸蔵合金の水素吸収・放出特性を評価する手法として、曲線(圧力組成等温線)が使用されます.
合金を細かく粉砕して表面積を可能な限り増やし、耐圧容器の中に入れ、一定の温度に保って水素ガスと反応させます.代表的な曲線図を以下に示します.縦軸に水素圧力、横軸に金属中の水素量(
)を示すことが一般的です.

水素圧力をゆっくり上げていくと、まずがともに上昇する領域があります.この領域では、金属表面の水素分子が水素原子に解離して金属内に溶解し固溶体を形成します.
続いて、の量にかかわらず水素圧が一定の領域が現れます.この領域をプラトー領域と呼びます.プラトー領域では、水素が金属の結晶構造中に固溶する相と固溶する水素が規則配列する水素化物相が平衡状態となっており、水素圧が常に一定になります(ギブスの相律).
プラトー領域をすぎると、水素吸蔵能は低下し水素圧が再び上昇します.
十分な水素を吸蔵した後に水素圧力を下げ放出させていくと、吸蔵時と同様に放出のプラトー領域が現れます.通常、吸収時と放出時のプラトー領域の圧力は一致せず、ヒステリシスと呼ばれる差圧が存在します.
実際の水素吸蔵合金では、プラトー領域での水素の吸収・放出を利用しています.プラトー領域が平坦、かつ幅が広く、ヒステリシスが小さいほど僅かな圧力差で水素吸収・放出が可能となります.
一般に、高温になるほどプラトー領域の圧力が高くなります.そのため、圧力一定のまま温度を制御することによっても水素を吸収・放出することが可能です.
水素吸蔵合金を実用化するにあたって、安定性・耐久性も重要なパラメータになります.種々の合金について、水素の吸収・放出サイクルを繰り返すことで、合金の劣化の度合いを調べます.
合金によって劣化要因は様々で、温度による劣化、水素吸収による劣化、水素ガスに含まれる不純物による劣化が挙げられます.不純物によって合金表面に酸化被膜が形成されると、水素吸蔵能が低下します.
水素吸蔵合金の利用
水素吸蔵合金は、水素の貯蔵以外にも様々な応用先があります.
水素吸収時の発熱、水素放出時の水素圧、水素の脱挿入に伴う電荷変化などが利用できます.例えば、ヒートポンプ、コンプレッサー、水素透過膜としての応用が進んでいます.また、水素吸収によって金属が脆くなる性質(水素脆性)を利用して合金の粉体化、緻密化へ利用する向きもあります.
電池としての利用
中でも、水素吸蔵合金の応用が進んでいる分野は、電池材料です.
水素吸蔵合金が可逆的に水素を吸収・放出する性質と高密度に水素を貯蔵できる性質を活かし、水素吸蔵合金を負極とするニッケル水素二次電池が実用化されています.ニッケル水素二次電池は、従来のニッケル・カドミウム電池よりも小型、軽量かつ高いエネルギー密度を持っています.
ニッケル水素二次電池については、別の記事で解説します.また、燃料電池自動車にも水素吸蔵合金の利用が推進されています.
水素吸蔵合金の開発
水素吸蔵合金の開発研究は、1967年にReillyらがにおける大量の水素吸蔵能力の発見によって始まりました.その後、1970年にPhilips社により、
が室温で水素を可逆的に吸収放出することが報告されました.
は、今でも最も代表的な水素吸蔵合金であり、組成式あたり6つの水素を貯蔵可能です.
その後、松下電器がを発見するなど、日本メーカーによる水素吸蔵合金の報告が相次ぎました.
代表的な水素吸蔵合金のエネルギー密度を下図に示しました.

エネルギー密度は、体積密度と質量密度の2つの観点で評価されます.
前者が大きければよりコンパクトになり、後者が大きければより軽量な材料となります.水素ガスはボンベの重量・大きさがある分、どちらのエネルギー密度も大きな値になりません.
水素吸蔵合金のメリットは、水素ガスに比べて体積あたりのエネルギー密度に優れる点です.これにより、スペースに限りがある車載用としての用途に期待が持てます.
一方、合金自体の重さがある分、重量エネルギー密度には課題があり、デバイスの重量が増えるというデメリットがあります.より水素の吸収容量の大きい合金材料の開発が必要とされています.
まとめ
水素社会を実現するには、製造方法だけでなく保存・運搬方法まで合わせて考える必要があります.水素を貯蔵するという観点では、高圧ガス水素、液体水素のほか、アンモニア()のように分子内に水素を貯蔵する方法があります.これらの手段に比べて水素吸蔵合金は安全性に優れており、常温・低圧の温和の条件での水素の脱挿入が可能です.
一方で、合金本体からくる重さは如何ともし難く、などの金属を用いてより軽量な合金の開発がなされている(と思います).ゆくゆくは燃料電池、電気自動車への展開へ向けて、より高いエネルギー密度を持つ材料の開発が必要となっています.
参考文献
RESOURCES PROCESSING 1999 Volume 46 Issue 2 Pages 75-81
日本機械学会誌 2009 年 112 巻 1085 号 p. 289-291
化学と教育 2018 年 66 巻 10 号 p. 488-489
化学と教育 2007 年 55 巻 9 号 p. 446-449
化学と教育 2000 年 48 巻 8 号 p. 516-518
応用物理 2021 年 90 巻 9 号 p. 570-573
応用物理 2021 年 90 巻 9 号 p. 570-573