鉛蓄電池(Lead–acid battery)
昔の携帯ゲーム機は、乾電池を交換するのが当たり前でした.電池が切れる前にセーブできるかハラハラしたものです.
そのうち時代は進み、ニンテンドーDSくらいの時期には充電可能な電池が普及していました.電池を入れ替える必要はないですが、充電が切れる前にセーブできるかハラハラする状況は変わらずです.
このように充電できる電池が使用されるようになったのはつい最近のことです.
…なんて思っている人はいませんよね?
それよりも遥か前から充電池は発明され、暮らしに身近なある製品に使用されていました.
今回は、史上初の充電池である鉛蓄電池について見ていきます.
鉛蓄電池の概要
鉛蓄電池は、1859年にフランスの物理学者Gaston Plantéによって発明された、史上初めての充電可能な電池(二次電池)です.
発明から150年以上たってなお鉛蓄電池は産業で重要な存在であり、主に自動車用のバッテリーとして利用されています.リチウムイオン電池が比較的普及した現代においても、二次電池の全生産量の半数以上が鉛蓄電池です.
Planté が最初に発明した電池は2枚の鉛板の間に2本のテープを挟んで円筒状に巻きつけたものでした.1881年には Camille Alphonse Faure が格子状の鉛板に酸化鉛のペーストを押し込むことで、大量生産が容易な形に成形しました.鉛蓄電池で起こる反応はGladstoneとTribsによって定式化されました.
鉛蓄電池の起電力はおよそ2Vです.安価、高出力、製造が容易、かつリサイクルが可能であり、自動車用バッテリーとして適した特性を持ちます.コストパフォーマンスに優れており、長寿命化や密閉化の改良が行われながら使用が継続されています.
一方、大型で重く、充放電のサイクル寿命が短く、有毒な元素()を含むという特徴から日用品に組み入れるには向きません.
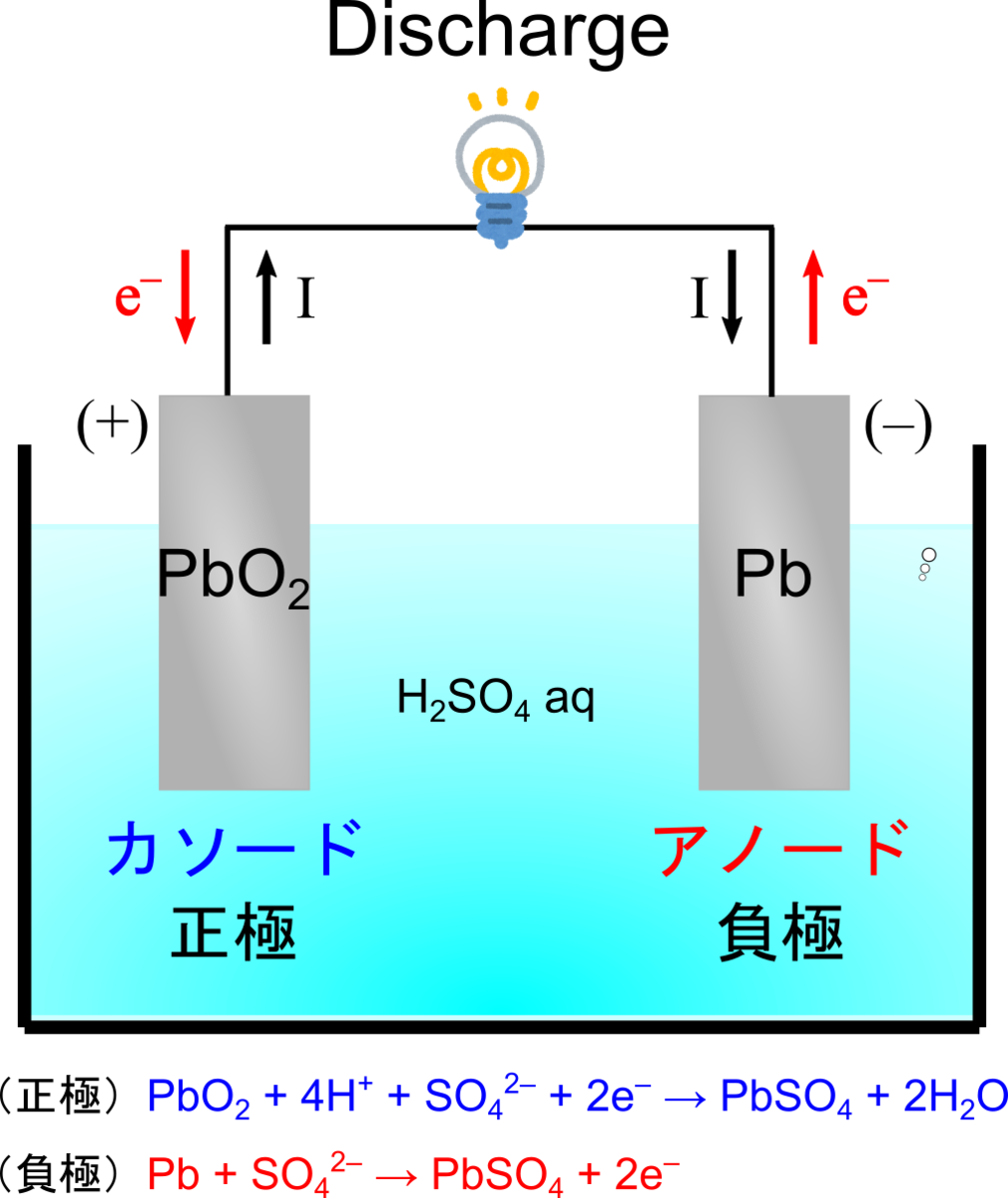
鉛蓄電池の反応
鉛蓄電池には正極材料として酸化鉛()、負極材料として鉛(
)、電解質として希硫酸(37 wt% 程度の
水溶液)を使用します.
放電反応の際にはいずれの電極も硫酸イオンを消費して硫酸鉛()を形成します.
すなわち、放電において各電極では、以下のような反応が起こります.
(負極):
(正極):
(全体):
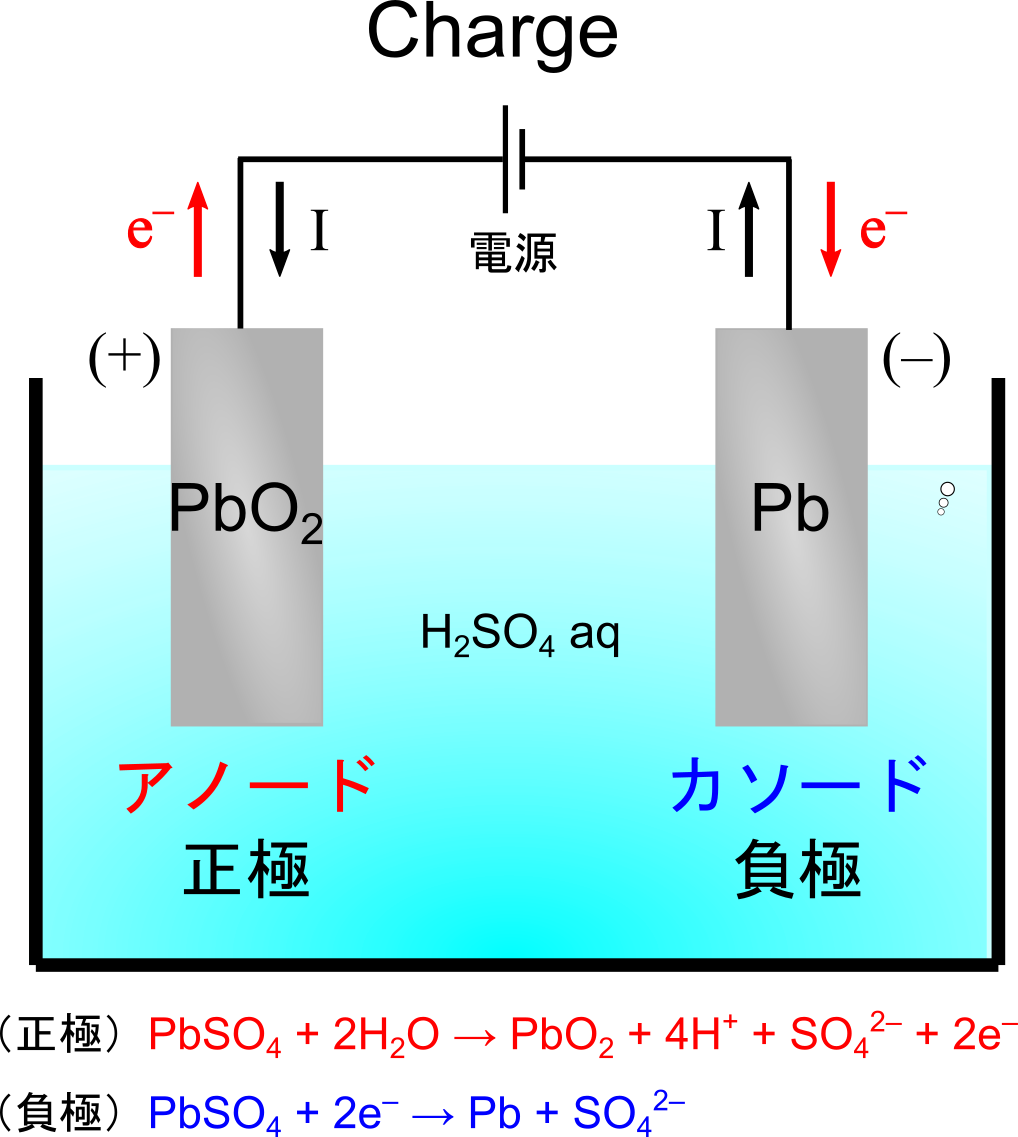
充電反応では上式の逆の反応が起こります.
や
と
は全く異なる結晶構造を持っています.鉛蓄電池の放電反応では、
や
が強酸溶液に溶けて
が生成した後に、
と水が生成します.
この反応は非常に大きな体積膨張を伴い、逆に充電の際は体積が縮みます.このように反応には硫酸イオンが本質的に関わっており、一定量以上の硫酸を用意することが必須となります.
鉛蓄電池は放電が進むにつれて導電性の低いが電極表面に形成されるため、放電を行えば行うほど抵抗値が大きくなります.鉛電池が放電しきると負極表面に硫酸鉛の白い結晶が生じるサルフェーション現象が起こり、電池容量が減少します.
一方、満充電した鉛蓄電池では電池内部で自己放電が起こります.鉛蓄電池を充電した状態で放置しても自己放電によりサルフェーション現象が起こります.このため自動車の鉛蓄電池はこまめに充電したほうが長持ちします.
まとめ
鉛蓄電池は最初期の電池であるにも関わらず、改良を続けられながら現在でも使用され続けています.デメリットはあるものの、安価、高出力、製造が容易、かつリサイクルが可能な特性は工業化に向いており、今後も使用され続けることでしょう.
鉛は、遷移金属でないにも関わらず複数の陽イオンの価数をとれる珍しい元素です.個人的には、同じ特徴を持つスズやビスマスで同じような電池は作れないのかなあと思います.
参考文献
化学と教育 1998 年 82 巻 10 号 p. 830-833
化学と教育 2001 年 49 巻 1 号 p. 24-27
Lead-acid battery technologies: fundamentals, materials, and applications. Crc Press, 2015.