更新 2024-2-25
孤立電子対(非共有電子対、Lone pair)
原子と原子が電子を一つずつ分け合うことにより結合を形成し、分子が生成します.このような結合を共有結合と呼び、共有結合に関与する電子2つの対を結合電子対(共有電子対)と呼びます.
一方で、中には結合する原子を見出すことができないまま孤立した電子の対が残ることもあります.このような孤立電子対(非共有電子対)は、目には見えませんが分子の形状や水素結合の形成を通じてその存在をアピールしてきます*1.
分子の形と孤立電子対
二酸化炭素分子()は直線状ですが、水分子(
)は折れ曲がった形をしています.
この違いは孤立電子対の有無によって決まります.

二酸化炭素には孤立電子対が無いため、と
の結合に関与した2セットの結合電子対(二重結合のことは今は気にせず進めましょう)が互いにクーロン斥力を最小化させるために直線状に配置します.
一方、水には2セットに結合電子対の他に2セットの孤立電子対が有るため、4つを互いに最大限引き離すために合計4つの電子対を四面体状に配置します.孤立電子対は目に見えないため、結果的に折れ曲がったの並びだけが見えるわけです.
他にも、アンモニア()が三角錐型であることなども孤立電子対によって説明できますが、こういった分子の形状について詳しくは原子価殻電子対反発則(VSEPR)の記事で述べることとします.
今回の記事では分子を通り越して、固体の中における孤立電子対の役割を見ていきます.
固体における孤立電子対[a]
孤立電子対と水素結合
固体の話をするにあたって、最初にまた水について考えましょう.今度は単分子の水ではなく、固体(氷)になった状態の水です.氷の中では、孤立電子対の存在がより際立ちます.
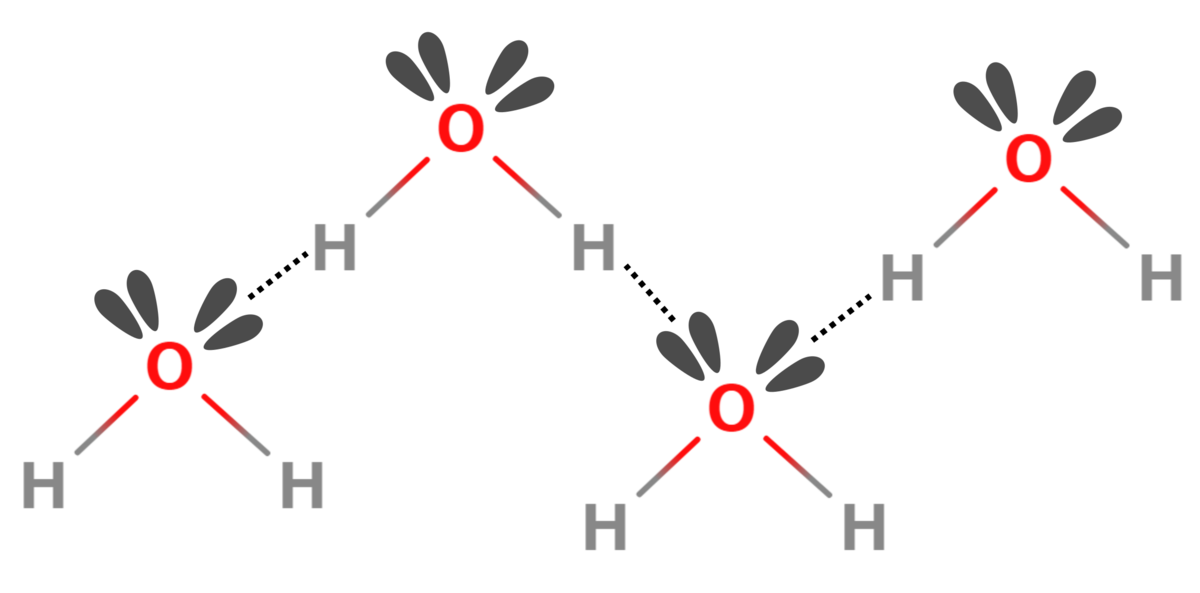
氷が結晶化する際、水分子はあるルールに従って凝集します.水は極性分子であり、水素に正電荷が、酸素に負電荷が集まっています.この水素の僅かな正電荷は、他の水分子中の酸素の孤立電子対と静電的な結合を形成します.
このようにして生成する水素結合は、孤立電子対があるからこそ起こるものです.
孤立電子対とイオン結合
孤立電子対は分子や分子結晶から離れて、イオン結合性の物質にも影響を及ぼします.金属が陽イオンになる時は価電子を手放すので、ほとんどの陽イオンは孤立電子対を持ちません.
しかし、鉛が2価の陽イオンになる際には、 の電子配置を取ることでs軌道に孤立電子対が残ります.同様のことは、他の14族元素(
など)や3価の15族元素(
など)にも言えます.
は
と近いイオン半径を持ちますが、孤立電子対の有無を反映して両者の結晶構造には大きな違いが現れます.
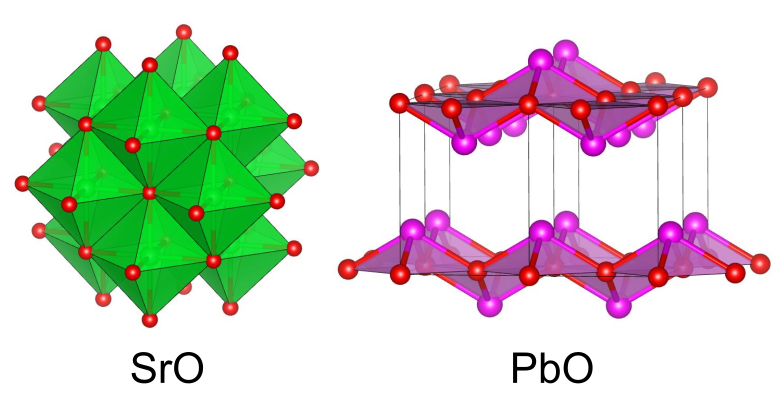
の結晶構造は岩塩型構造であり、
6つから成る八面体のちょうど真ん中に
が配置しています.
一方、の結晶構造は
とは似ても似つかない奇妙な層状構造となります.
は
に4配位されていますが、
を囲むようには配置されていません.
これは、の孤立電子対の存在によって配位が歪んだことによると解釈されています.ちょうど水の分子構造が折り曲がるのと同じで、
の孤立電子対が
と反対側の層のどこかに局在しているのだと思われます.
このように孤立電子対が局在して結晶構造に影響を与えることを、「立体化学的に活性」という言い方をすることもあります.
孤立電子対と結晶構造
このように孤立電子対によって引き起こされた歪んだ構造は、他の14族元素(陽イオン)と16族元素(陰イオン)の組み合わせでも見られます.とはまた違う構造ですが、
でも同様に正多面体から歪んだ陰イオンの配位が見られます.
一方で、や
では孤立電子対は立体化学的に活性ではないようで、
と同じく対称性の高い岩塩型構造をとります.このような違いは何によってもたらされるのでしょうか.
そもそも、s電子は等方性なので、のように孤立電子が局在しているというのもおかしな話です.かつてOrgelは、孤立電子対が立体化学的に活性であるためには、ある程度のs軌道とp軌道の混成が必要であると述べました.[b]
しかし、や
の例では、立体化学的に活性かどうかを決めるのは、
の中でs軌道とp軌道が混成しているかどうかというよりは、相方の陰イオンの種類の問題であるように見えます.
この原因は、立体化学的に歪んだ構造が局所的にあったとしても、その方向が完全にランダムに分布していた場合、結晶構造は平均化された対称的なものになってしまい、マクロなスケールでは孤立電子対の効果が見えないから、とされています.
これにより、などの物質が、孤立電子対が存在するにも関わらず対称性の高い構造を持つことを説明できます.実際、通常の回折測定よりもさらに”ミクロな”環境を見ることのできる測定手法により、
で局所的な構造の歪みが存在することが明らかになっています.[c]
孤立電子対と機能性
さて、ここまで固体中の孤立電子対について見てきましたが、孤立電子対の役割は構造を歪ませるだけではありません.
以下では、孤立電子対の存在によってもたらされる様々な物性や機能の例を紹介します.
PbTiO3
ペロブスカイトと呼ばれる、化学式で表される物質群があります.ここで、大きな
陽イオンは12個の陰イオンに配位され、小さな
陽イオンは
陰イオンに八面体状に配位されています.
のように
を含むペロブスカイトでは、
が八面体の中心が外れることで非中心対称な構造となり、強誘電性が発現することがあります.
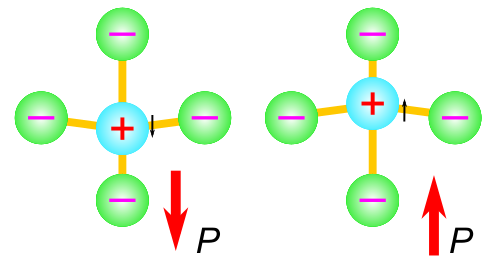
では、
由来の孤立電子対が、隣接する酸素の2p軌道と混成することで構造が歪みます.結果として、
の多面体環境と
八面体の双方に歪みが生じます.このように
と
の両方が協奏的に歪むことで、巨大な自発分極(室温で
程度)と室温以上の高い転移温度を示します.
このような特徴は強誘電体としての応用に好ましいものの、毒性のあるを含むことが実用上の妨げとなっています.
一方で、との固溶体を生成することで巨大な圧電性と強誘電性を示すことが知られています.PZTと呼ばれるこの材料は、他に同等の性能を示す材料がないがゆえに、有毒な
を含むにも関わらず工業的に用いられ続けています.
PbBiO2Cl
近年、光触媒の活性を高める手段として孤立電子対が注目されています.
光触媒とは、光が当たることで表面で強力な酸化力(と還元力)が生まれ、接触する水分子や有機化合物を分解することのできる材料です.太陽光によって水を分解して水素を発生させることのできる光触媒は、次世代のエネルギー材料と目されています.
多くの光触媒は半導体であり、特定のエネルギーを持つ光のみを吸収します.太陽光のエネルギー分布の大部分を占める可視光を利用できれば効率的ですが、多くの光触媒はより高エネルギーの紫外光しか吸収することができません.
半導体がどの波長の光を吸収できるかはバンドギャップによって決まるので、可視光を吸収するにはバンドギャップをなんとかして小さくする必要があります.
という酸塩化物では、
の孤立電子対を利用することで小さなバンドギャップを実現しています.(水の分解にはバンドギャップの大きさだけではなくバンド位置も重要ですが、ややこしいので今回は省略します)
と同じ構造をもつ
はバンドギャップが広く、可視光を吸収できないため真っ白な色をしています.しかし、
はバンドギャップが
のものよりも小さく、可視光を吸収することで黄色く呈色しています.
理論計算から、の価電子帯が
のものよりも高エネルギー側に押し上げられていることが分かりました.これは、孤立電子対が酸素と相互作用することで価電子帯のエネルギーが上昇したためと考えられています(リバイスドローンペアー効果).[d]
を用いることで、可視光によって水を酸素と水素に分解する光触媒反応が実証されています.[e]
PbVO3Cl
酸塩化物は温度によって異なる色を示します.すなわち、常温では黄色ですが、200℃以上では赤色になります.
このように温度で色が変わる現象をサーモクロミズムと呼びます.
通常、物性が顕著に変化する温度では構造の変化を伴いますが、は色の変化の前後で構造が変化しません.同様のサーモクロミズムは同じ構造を持つ
では観測されないことから、
由来の孤立電子対がこのサーモクロミズムに影響を及ぼしていると考えられています.[f]
様々な実験手法により、では温度上昇によって
が配位の中心から遠ざかることが分かっています.この際、
結合距離は縮むのに対して、
結合距離は殆ど変わりません.
これにより、孤立電子対と酸素の軌道が相互作用して価電子帯のエネルギーが上昇し、バンドギャップが狭くなることで物質の色が変わったのだと解釈されています.
まとめ
以上のように、孤立電子対は回折測定では目に見えないにもかかわらず、結晶構造や物性に大きな影響を与えることが分かっています.通常の回折測定では見えませんが、X線吸収分光や電子密度の解析でその存在を間接的に明らかにすることはできます.
ここでは紹介しきれませんでしたが、孤立電子対によって金属絶縁体転移を引き起こしたり、トポロジカルな物性が発現したりする場合もあります.孤立電子対は決して脇役ではなく、様々な物質機能の起源となっています.今後も、孤立電子対を用いた物質・物性設計が進められることと思います.
参考文献
[a] Accounts of Chemical Research, 2022, 55.7: 1004-1014.
[b] Journal of the Chemical Society (Resumed), 1959, 3815-3819.
[c] Science, 2010, 330.6011: 1660-1663.
[d] Chemical Society Reviews, 2011, 40.9: 4455-4463
[e] Chemistry of Materials, 2018, 30.17: 5862-5869.
[f] Chemistry of Materials, 2020, 32.17: 7404-7412.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).
*1:結合電子対も目に見えないよねというのは置いといて