
酸素の燃焼
酸素は、言うまでもなく生物にとって必要不可欠なものです.酸素自体が「発見」されたのは近代になってのことですが、太古から人類は酸素の存在を認識して文明を築いてきました.古代ギリシャの四元素説(空気、火、水、土)のいずれにも何らかの形で酸素が関わっています.酸素がなければ今の地球はありませんし、酸素のない火星を見れば、酸素が果たした役割の重大さが分かります.
酸素の唯一無二の特徴は、燃焼し炎を発することです.燃焼によって燃料の持つ化学エネルギーを外部に放出し、炉や熱機関を通じて産業で活用します.私たちの体内では、酸素による細胞呼吸によって生体反応に必要なエネルギーを取り出します.
では、なぜ酸素の燃焼によってエネルギーを取り出すことができるのでしょうか.火はなぜ熱いのでしょうか.化学的に言い換えるのであれば、なぜ酸素の燃焼は常に発熱反応なのでしょうか.もしこれが吸熱反応があればエネルギーは生まれず、酸素があったところで地球は死の惑星のままであったでしょう.
これは非常に基礎的な問題ですが、決して自明ではありません.二酸化炭素や酸化物の生成エネルギーが負だから?それは実測値から導かれた値であり、何の説明にもなっていません.
今回は、Journal of Chemical Education誌に掲載された文献を頼りに、なぜ酸素の燃焼が常に発熱反応なのか、その要因を見ていきます.[1]
燃料と発熱反応
まず、酸素の燃焼反応について復習しましょう.一般に、酸素が何らかの分子(多くは炭化水素)と反応し、対応する酸化物(二酸化炭素、水が主)を生成する反応を燃焼と呼び、単位量のある分子が完全燃焼したときに発生する熱を燃焼熱と呼びます.
通常は、燃焼熱をエンタルピー変化()として表します.
が負であるということは、反応物のエネルギー変化が負、すなわちエネルギーを放出する発熱反応であることを示します.
ガソリンや天然ガスは火力発電の燃料であり、豊富なエネルギーを取り出すことが可能です.このことから、これらの炭化水素は「高エネルギー密度」の物質であるとされます.実際、これらの燃焼では1 MJ/molを超える発熱を示します.
しかし、本当に炭化水素が「高いエネルギー密度」を持っているのでしょうか.例えば、以下の2つの反応を見てみましょう.
どちらも炭素と水素の反応ですが、反応熱は大きく異なっています.前者はわずかに発熱的であるのに対し、後者では酸素が反応に関わったことで発熱量が十数倍に増大しています.こうしてみると、発熱に重要なのは炭素よりも酸素なのではないかと思えなくもありません.
また、酸素とシリコンの反応を見てみます.
ここでは、炭化水素燃料を使っておらず.二酸化炭素や水を生成していないにも関わらず、非常に大きな発熱を示します.
他にも、酸素が関わるかどうかで発熱量が大きく異なる例が存在します.
燃焼による大きな発熱の理由を「安定な二酸化炭素が生成するため」とする場合があります.二酸化炭素は、大きな負の生成エネルギー()と大きな結合エネルギー(
)を持つためです.
しかし、これも必ずしも正しいとは限りません.二酸化炭素を生成物として含む反応であっても、発熱量が小さかったり吸熱反応であるものもあります.
また、二酸化炭素の持つ結合エネルギーはメタンと比べてもあまり違いがありません()し、二酸化炭素を発熱的にメタンに変換することさえできます.
さらに、ポーリングの電気陰性度の議論に基づく古典的な説明にも疑問が残ります.この説明では、電気陰性度の似通った元素を含む反応物から電気陰性度の大きく異なる元素を含む安定な物質が生成し、そのエネルギー差が反応熱として放出されるとされます.しかし、結合と
結合の結合エネルギーは似たような値です.
また、電気陰性度の大きく異なる窒素を含む反応は発熱的であることが期待されますが、実際は吸熱反応です.
酸素の持つ結合エネルギー
K. Schmidt-Rohrは、結合エネルギーの値を用いて様々な反応の燃焼エネルギーを整理しました.結合エネルギーとは、互いに引き合って化学結合を形成する原子に働く安定化エネルギーです.結合エネルギーが負に大きいほど、結合は強固であると言うことができます.
Schmidt-Rohrは、各分子内の全ての結合エネルギーを合算し、分子の安定性の指標としました.この際、二重結合を2つの結合があるとみなして二重に数え、三重結合についても同様です.
例として以下の反応を考えます.
は4つの
結合、
は2つの
結合、
は2つの
結合を含みます.
これらの結合エネルギーの合計は、反応物のと生成物の
および
の間でほぼ変わりません.残りのエネルギーはどこにあるのかと言えば、酸素の結合エネルギーが大部分を占めます.
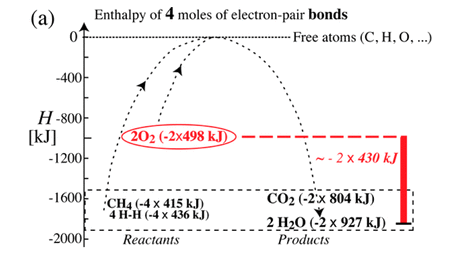
ということは、この反応における大きな燃焼エネルギーは「炭化水素の持つエネルギー」ではなく「酸素の持つ大きなエネルギー」が主に寄与しているのではないかと考えられます.すなわち、大きな発熱の原因は炭化水素ではなく酸素なのではないかと思えるわけです.この場合、酸素1 molあたりという大きなエンタルピー変化を説明します.
この値は、炭化水素の種類に関係ないため、反応式における酸素の関与する数さえ分かれば燃焼熱がある程度予測できることを意味します.
一方、燃焼熱の値は標準状態(298 K、1bar)でのの状態である
への反応に基づいています.
から
への変換では、凝縮熱
も併せて考える必要があります.
すなわち、以下の反応式において
の係数
および
の係数
を用いて反応熱を予測可能であることが考えられます.
燃焼熱の予測
燃焼反応式の係数だけで燃焼熱を予測することなど可能なのでしょうか.驚くことに、この非常に簡潔な式から予測される燃焼熱と実際の燃焼熱は非常に良い一致を示します.下図は、500以上の炭化水素物質について燃焼熱をプロットしたものです.
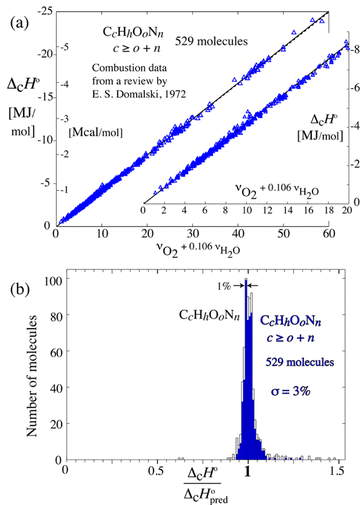
実測値は、式から予測される直線上にあり、大きくても数%のズレしか生じません.これにより、例え炭化水素の分子構造や個々の構成物質がわからなくても、平均的な組成さえわかれば燃焼熱が分かることになります.
燃焼熱が、燃焼反応に関わる酸素分子の数で決まるということから、様々な考察が可能です.
燃料には、炭素と水素以外にも酸素や窒素が含まれていることがあります.窒素は燃焼反応に関与しないので、燃焼熱には一切影響を与えません.一方、燃料に酸素が含まれている場合(例えばアルコールなど)、その分燃焼反応に必要な酸素分子の量が減少するため、燃焼熱は小さくなります.
例えば、の燃焼熱は
のものよりも3割程度小さい値を示します.このことから、バイオ燃料等から酸素原子を除くことは燃焼エネルギー効率を高めるために重要になってきます.
また、酸素を含む分子が分解する際になぜ酸素分子ではなくや
の形で脱離することが多いのかも説明することが可能です.酸素の結合エネルギーが非常に弱いために生成に大きなエネルギーが必要であり、代わってより生成しやすい
や
が脱離することになります.
オクタンやメタンなどの炭化水素は高エネルギーの燃料として語られますが、酸素が存在しない雰囲気ではエネルギーを取り出すことができません.これらは燃焼によって酸素のエネルギーを取り出すことによってはじめて、高エネルギーを発することができるのです.
まとめ
「なぜ火は熱いのか」「何が火を熱くするのか」という問いは単純ですが自明ではありません.その原因は何なのでしょうか.
今回紹介した内容によれば、「の二重結合が、他の二重結合や結合のペアと比べて異常に弱い」「
や
の強い結合が形成されると分子の位置エネルギーが下がり、熱が放出されたりガス分子の熱運動が大きくなる」ことで燃焼熱を説明可能です.
驚くことに、非常に単純な関係式から非常に多くの種類の炭化水素の燃焼熱を定量的に求めることができます.この考えに従えば、組成や化学的な性質が分かっていない燃料であっても、平均的な組成さえ求めれば、燃焼熱が分かることになります.
参考文献
[1] "Why combustions are always exothermic, yielding about 418 kJ per mole of O2." Journal of Chemical Education 92.12 (2015): 2094-2099.
"Combustion, Chemistry, and Carbon Neutrality." Chemical Reviews (2023).