更新 2024-2-25
リチウムイオン電池の正極材料
リチウムイオン電池は携帯電話から電気自動車まであらゆる電子デバイスに用いられ、現代社会にとっての必需品となっています.
従来の発電方法と異なり化石燃料を用いることなく大きな電力を取り出せるため、太陽光発電や風力発電のようなクリーンで持続可能なエネルギー源としても期待されています.2019年にはノーベル化学賞がリチウムイオン電池への貢献に対して送られました.

今日までのリチウムイオン電池の発展は一つのブレークスルーによるものではなく、半世紀近くにわたる基礎研究の積み重ねの成果です.新しい物質の発見と、その構造・物性の基礎研究がこの分野の発展を着実に進めてきました.
リチウムイオン電池は、従来の電池と同じく2本の電極(正極、負極)と電解質から構成されます.このうち、特にエネルギー密度に影響を与えているのが正極材料です.
現在、正極材料として使用されている材料は主として金属酸化物であり、大きく3種類のグループに分けられます.これら(層状酸化物、スピネル系酸化物、ポリアニオン系酸化物)はいずれも2019年のノーベル化学賞受賞者John Goodenoughのグループで見出されたものです.
リチウムイオン電池の解説は以前に行いましたが、今回は特にリチウムイオン電池の正極材料について見ていくこととします.

正極材料のはじまり
インターカレーション反応の発見
リチウムイオン電池の材料開発において重要なキーワードは「インターカレーション反応」です.
インターカレーションとは、層状構造やカゴ型構造などのように「すき間」を持つ物質に他の化学種を挿入するような反応を指します.

古くは19世紀から知られ、1841年にSchauffautlがグラファイトに硫酸イオンをインターカレーション可能なことを示しました.
1960年代に入るとインターカレーション材料への関心が高まり、特にゲストイオンの脱挿入によって材料の電子的・光学的特性を変化させることが注目されました.金属硫化物や
などをターゲットとし、インターカレーションによる金属絶縁体転移、構造相転移、超伝導などの研究が行われました.
そんな中、WhittinghamはアメリカのExxon社において、正極に層状構造を持つを、負極に
金属を、電解質に
などのリチウム塩を有機溶媒に溶解した液体を用いたリチウム二次電池を発表しました.この電池は 2.5 V 程度の放電電圧を示し、良好なサイクル特性を示しました.しかし、負極材料に問題があり、実用化には届きませんでした.
当時、負極材料には金属がそのまま使用されていました.金属
は不安定で扱いにくいことに加え、充電の際に
が針状に析出してしまいます.そのため、充放電サイクルを繰り返すと析出した
が負極を突き破って電池を短絡させ、火災が起こる危険がありました.
結果として、Whittingham式電池が市場で見られることはありませんでした.
酸化物正極材料の発見
しかし、インターカレーション反応のコンセプトの影響は大きく、世界中の研究グループで新材料の探索が行われました.その一つが、後にWhittinghamとノーベル化学賞を共同受賞することになるJohn Goodenoughのグループです.
1978年、Goodenoughのグループを訪れていた水島公一氏は、Whittinghamのコンセプトに基づき硫化物の正極材料を探索していました.
お隣の研究室で特製の電気炉を使用して合成を行っていたのですが、ある日、合成中の試料が爆発してしまったそうです.このことからお隣の研究室の電気炉を使用するのが難しくなり、その後は合成が容易な酸化物の中から正極材料を探索し始めました.そして、水島氏は数ある酸化物の中から、当時は磁性体として知られていたなどの材料に目をつけました.
電池の電圧は、正極と負極の電極電位の差で決まります.すなわち、正極のエネルギーはできるだけ低く、負極のエネルギーはできるだけ高くすることで、大きな電位差を生み出すことができます.
電子は負の電荷を持つので、正電荷によって安定化されます.陽イオンの価数が大きければ大きいほどクーロン力によって電子のエネルギーが下がるので、いかにして価数の大きい金属イオンを利用するかが電圧を高めるために必要なことでした.
水島氏が硫化物から酸化物へ目を移したことは、電子エネルギーの観点で重要でした.少し専門的になりますが、バンドエネルギーの観点から酸化物材料のメリットを説明します.バンド図の上に行くほど電子のエネルギーが上がることと、電子は特定のエネルギーを持つ「バンド」にしか占有できないことを覚えておけば十分です.
硫化物におけると酸化物における
はどちらのほうが高いエネルギーを持っているでしょうか.
の価電子軌道である3p軌道のほうが当然酸素の2p軌道よりも高いエネルギーを持ちます.

硫化物で低エネルギー・高価数の金属イオンを使おうとすると、どこかでの3p軌道の壁にぶつかります.すなわち、電子はエネルギーの高い
の3p軌道から低エネルギーの金属イオンに流れ込んでしまい、
が還元されてしまいます.
一方、酸化物イオンの軌道エネルギーは低いためこのような問題は起こらず、金属イオンの低エネルギー軌道を存分に利用して電極電位を下げることができ、より高い電圧を実現可能です.
水島氏とGoodenoughは見事に「高価数・低エネルギーの金属イオンを利用可能」な「酸化物」であると
に行き着きました.
特には高い起電力と優れたサイクル特性を示しました.このように黎明期に見つかった
が今も現役で使用されていることは驚きに値します.
の発見は酸化物正極材料のポテンシャルを見せつけた結果となりました.その後、同様にGoodenoughのグループから続々と酸化物正極材料の報告がなされています.
こうして見出された3つの構造グループ(層状酸化物、スピネル系酸化物、ポリアニオン系酸化物)は現在でもリチウムイオン電池を支える重要な材料です.
以下では、リチウムイオン電池で使用される正極材料について見ていきます.
代表的な正極材料
層状酸化物(LiCoO2など)

上述の通り、は正極材料として最初に開発された酸化物材料です.
は
型構造と呼ばれる層状構造を持ちます.これは、有名な
型構造中で1価の
イオンと3価の
イオンを(111)面上で交互に配列することで得られる結晶構造です.
では、
イオンも
イオンも酸素に八面体配位されています.このような構造はO3構造とも呼ばれます.
は固相法によって容易に合成が可能な安定な物質です.一方で、
は層状構造を持つため、層からジェンガのように
を引き抜くことが可能です.リチウムは、八面体サイトから隣接する四面体の間隙を経由して別の八面体サイトへ移動します.また、
では
同士の距離が近く、
と
の間を経由して電子が移動するため、高い電子伝導性も示します.
このような構造安定性と高いイオン伝導性、高い電子伝導性は、電池の正極材料として非常に魅力的です.
正極は 4 V という高い動作電圧を持ちながら、可逆的に高速な充放電が可能です.
は現在でも利用される主要な正極材料の一つです.
は大きな理論容量密度(274 mA h/g)を持ちますが、
を50%以上引き抜くと結晶が壊れてしまう(ジェンガで1列のブロックすべてを引き抜くようなものです)ため、実用的には 140 mA h/g 程度の容量密度で利用されます.
はWhittinghamの
正極とは異なり、構造中に最初から
を含んでいます.これにより、負極に金属リチウムを使用しなくても電池内に
を供給することが可能です.この特徴は、後にグラファイトなどの炭素材料のようなリチウムの貯蔵物質と組み合わせたリチウムイオン電池の発明につながりました.
の課題は、高価な
を用いることと実用的な容量密度が小さいという点です.
の使用量を減らすため、
サイトの一部に
や
を置換した
という材料の開発が進められました.
は安価で地球上に豊富であり化学安定性を高めますが、電子伝導性が低くなります.
はこれらの性能が
と
の中間に位置します.
このことから、と
と
の量をうまく調整することで安定性とコストと性能のバランスを取った材料が研究されています.
スピネル型酸化物(LiMn2O4など)

をはじめとするスピネル型酸化物は2番目に開発された正極材料です.
スピネル構造はやや複雑で、四面体と八面体が頂点共有でネットワークを形成した立方晶の構造を持ちます.は四面体サイト、
は八面体サイトを占めます.
イオンは四面体サイトから空の八面体サイトを経由して別の四面体サイトに移動が可能です.また、
と同様に
の間で電子が移動可能なため高い電子伝導性を示します.
は
とは異なり三次元的な結晶構造を持ちます.このため構造が堅牢であり、
よりも良好な充放電特性とサイクル特性を示します.結果として、4 V 程度の高い動作電圧と 130 mA h/g 程度の容量密度を実現しています.
は
よりも2桁ほど安いため、
は工業的な利用に適しています.しかし、電解質に僅かな量の酸が存在するだけで
が溶解してしまうという致命的な問題が指摘されています.
に含まれる
は酸性溶液中で容易に
と
に不均化し、
が溶液中に流出します(ラチマー図、フロスト図を参照).また、溶出した
は負極に移動して炭素材料を汚損し、電池の寿命を縮める原因となります.
スピネル型酸化物においても金属イオンの置換による特性を改善させる取り組みがなされています.しかし、とは異なり
を
や
に置換することは困難です.[
では3価と4価の
イオンを含みますが、4価という高い価数は通常
や
では通常とることができません.このため、
を少量だけ他の遷移金属で置換することによる性能改善が試行されています.
ポリアニオン酸化物(LiFePO4など)
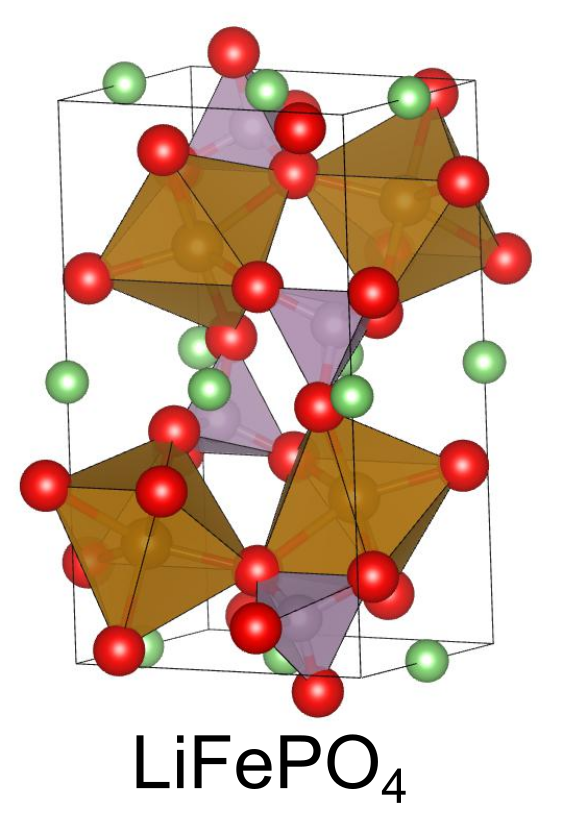
3番目に開発された正極材料がポリアニオン酸化物です.ポリアニオンとは、や
のように一塊のユニットが陰イオンとして振る舞っているような物質です.ポリアニオンの種類は豊富にあり、それゆえポリアニオン酸化物の数も莫大です.
と
はポリアニオン酸化物の一種であり、電気化学反応によって可逆的なLiイオンの脱挿入が可能です.
と
は
と
の酸化還元により正極として機能しますが、放電電圧は 3 V 程度(vs
)です.
驚くべきことに、同じくと
の酸化還元を利用する単純な酸化物
や
の放電電圧は 1.5 V 程度です.
すなわち、単純な酸化物からポリアニオン酸化物になることで電圧が大きく向上することが分かりました.ポリアニオンの種類を変えたでは放電電圧は 3.6 V にまで上昇します.この結果は、ポリアニオンの存在によって高い動作電圧を実現できる可能性を示唆するものです.
オリビン酸は代表的なポリアニオン酸化物の正極材料です.
は優れた熱安定性と構造安定性を示し、160 mA h/gと大きな容量密度を持ちます.
という安価な金属を含むことも魅力的です.
一方で、電圧は 3.4 V 程度と一歩及ばず、電子伝導度とイオン伝導度がともに低いです.電子伝導性がないと正極として機能しにくいため、炭素材料をコーティングし伝導性を高めた状態で使用されます.この影響で、実際に電池を組んだ際の容量密度はもう少し低下します.
その他にも、や
などのポリアニオン酸化物系正極材料の研究が行われています.
まとめ
リチウムイオン電池の発展の歴史には、正極材料の進化の歴史も含まれます.驚くべきことに、リチウムイオン電池の正極材料は研究の初期に見つかったものが現役で使用されています.
酸化物は安定性や軌道エネルギーの面で正極材料として都合が良く、正極材料の研究が硫化物から酸化物へ転換したことは歴史の変わり目であったと言えます.後から考えてみると、どうして先に不安定な硫化物のほうが先に研究が進んだのかと不思議に思いますが、逆にどこかでインターカレーションの概念が導入されなければリチウムイオン電池の研究自体が進んでいなかったかもしれません.
リチウムイオン電池はこの30年で大いに発展し、容量も限界に近づいています.電力の需要が止むことのない世の中で、次にブレークスルーを起こすのはどのような物質でしょうか.
参考文献
日本物理学会誌 2021 年 76 巻 1 号 p. 48-50
ACS central science, 2017, 3.10: 1063-1069.
Nature communications, 2020, 11.1: 1-9.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).