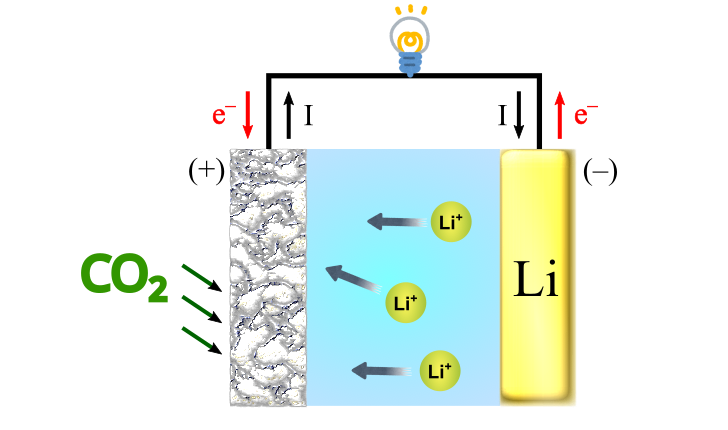
リチウム二酸化炭素電池(リチウムCO2電池、Li-CO2 battery)
二酸化炭素()の排出抑制のために化石資源の使用を控えるのは手ですが、発展しすぎた文明の時計の針を戻すのは困難です.では、排出量を減らすのではなく、新しい有効活用先を見つけるのはどうでしょう.
例えば、を電池材料として使ってみるとか.
炭素材料の「燃えカス」であるには新しいエネルギーを作り出す力は残っておらず、再利用するにはエネルギーを注ぎ込む必要があります.太陽エネルギーを用いる、余った電力や排熱を注ぎ込むなど手段は様々ですが、なかなか思い通りに反応は進んでくれません.空気中に散らばった
を一か所に集めることも、
を効率的・選択的に有用な材料に変換することも一筋縄ではいかない課題であり、
を有用な材料として再利用する取り組みが世界中で行われています.
こうしたの活用方法の中でもとりわけ目を引くのが電池材料としての利用です.
を電池材料として使うことができれば、
を貯蔵する目的とエネルギー源として利用する目的の両方が果たせて一石二鳥です.
実際、リチウムとを用いるリチウム二酸化炭素電池は広く研究されており、大きな出力(約2.80 V)と容量(約1880 Wh/kg)を示す新しい電池として期待が高まっています.
しかし、気体でありエネルギーに乏しいをどのようにして電池材料として使うというのでしょうか.今回は、次世代の電池であるリチウム二酸化電池について見ていきます.
- リチウム二酸化炭素電池(リチウムCO2電池、Li-CO2 battery)
- 電池材料としてのリチウムと二酸化炭素
- リチウム二酸化炭素電池の反応
- リチウム二酸化炭素電池の反応メカニズムと課題
- まとめ
- 参考文献
電池材料としてのリチウムと二酸化炭素
は炭素資源を燃焼したときの最終生成物であり、熱力学的に非常に安定です.2つの
結合を持ち、その解離エネルギーは 750 kJ/mol と非常に大きく、この値は
結合(327 kJ/mol)、
結合(336 kJ/mol)、
結合(441 kJ/mol)のものをはるかに上回ります.
結合が安定であるほど解離するために必要なエネルギー量も大きくなるため、を還元するには多大なエネルギーが必要です.
そこで登場するのが金属リチウムです.リチウムは非常に強力な還元力を持ち、分子から酸素原子を取り出すことができます.リチウムによる還元反応が自発的に起こることを利用して電気エネルギーを取り出すデバイスがリチウム二酸化炭素電池です.実際には、リチウム以外でも電気的に陽性な金属元素を用いることで金属二酸化炭素電池を作ることが可能です.
リチウム二酸化炭素電池に先立つ電池としてリチウム空気電池がありました.これは空気中の酸素を電池材料として利用し、リチウムイオン電池を超える出力を持つ電池として期待されているものです.
当初、空気中に否応なく含まれるは、リチウム空気電池にとって有害な成分であると考えられていました.実際、リチウムと
の反応によって
や炭素が生成するわけですが、この反応のみを取り出して新しい電池とみなしたのがリチウム二酸化炭素電池です.
リチウム二酸化炭素電池の反応
リチウム二酸化炭素電池では以下のような反応で放電が起こるとされています.
が還元されて生成した
と炭素は、適切な触媒と十分な電力を用いることで分解され、
へと戻ります.すなわち、リチウム二酸化電池はある程度充電することが可能です.
リチウム二酸化炭電池の負極には金属リチウムをそのまま使いますが、正極で反応に関与するをそのまま電極にするわけにはいきません.金属空気電池で培った方法に倣い、正極には多孔質材料を用いて
を吸着・保持し、電池反応に参加させます.
リチウムは水との反応性が高いため非水電解質を用い、電解質に浸したセパレーターとともに電池を構成します.一方、比較的反応性の低いマグネシウム、アルミニウム、亜鉛などを負極として用いる場合には水系の電解質が使われます.
リチウム二酸化炭素電池は、リチウムの標準還元電位()があらゆる元素の中で最も負に大きく、リチウムの理論容量(3861 mAh/g) が非常に大きいため、非常に大きな出力(2.80 V)と理論エネルギー密度(1880 Wh/kg)を持ちます.
不要なを貯蔵・再利用でき、そのうえで非常に優れた特性を示すという夢のような電池ですが、もちろん良い話だけではありません.
電池の性能向上のためにも安全性確保のためにも反応メカニズムの理解は欠かせませんが、現状では発展途上と言えます.以下では、現段階で分かっている反応メカニズムについて見ていきます.
リチウム二酸化炭素電池の反応メカニズムと課題
がどのようなメカニズムで還元されるかは自明ではなく、一説では
などの複数の中間体を経由するとされています.
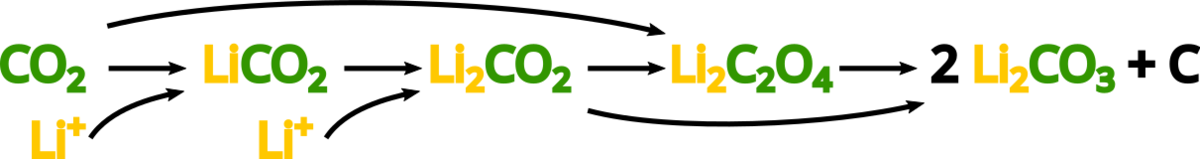
まずが電極上の触媒サイトに吸着し、電子を受け取って
と結合することで
が生成します.
同様に電子とを受け取って
となり、さらに
と結合することで
を形成します.その後、
と
との間の化学反応で
および炭素が生成して反応が終わります.
実際にはが電解液中に溶出するなどもっと複雑な反応も起こっているようです.以上の反応は非常に速く起こっており、現在の測定技術で放電反応のすべての段階を捉えることはなかなか難しいと言えます.
リチウム二酸化炭素電池の課題
放電反応の生成物であるは厄介な課題を抱えています.充電を行うには
を電気分解する必要がありますが、絶縁体であり電解液に不溶な
の電気分解には大きな過電圧が必要であり、エネルギー効率の低下および他の構成要素への過度な負担となります.
放電の反応式を逆にたどると、理想的にはと炭素が反応することで
へと戻るはずですが、実際にはルテニウムなどの触媒を使用しない限りは
のみの自己分解が起こることが知られています.このように充電反応についても分かっていないことは多くあります.
気体であるの関わる電池反応は、ガス/波体/固体の界面が関わる非常に複雑なものであり、電池の実用化を阻む要因はいくつも存在します.
まず、は反応性が良くなく、還元・発生反応に複数の中間状態を含むものであることから反応速度が遅く、エネルギー効率が低くなります.また、放電時に絶縁体の中間物質が活性部位を覆い、それ以上反応が進行しなくなる恐れがあります.さらに、充電反応では、生成物の分解に伴う高い酸化電位によって電解質の分解や炭素基板の腐食を引き起こし、電池の信頼性に問題が生じるかもしれません.
リチウム二酸化炭素電池の性能を向上させ、実用化を目指すには、触媒や電解質の設計の見直しや反応メカニズムの理解が求められます.また、電池の動作のためには空気中に散らばったを大量に回収してくる必要もあり、こちらも別に解決すべき課題です.
地球上では二酸化炭素の確保が別に必要ですが、大気の95%がである火星においてはそうした心配はいりません.もしかすると地球よりも先に火星で実用化されるのかも.
まとめ
無尽蔵に化石資源を消費していた時代は終わりを告げ、の消費量を抑えるか新しい活用先を模索する時代になってきました.
を電池材料として用いるリチウム二酸化炭素電池は、その解決に向けた一つの手段であると言えます.
二酸化炭素を回収・貯蔵した上でエネルギー資源として再利用でき、しかもあらゆる電池の中でトップクラスの出力・容量を示すリチウム二酸化炭素電池は、カタログスペックだけ見ると夢のような電池です.
しかし、うまい話だけがあるわけでもなく、ここでもの取り扱いの厄介さが顔を出します.実用化にはまだ時間がかかりそうです.しかし、リチウムイオン電池のように、山積みした課題を一つ一つ乗り越えて発展してきた電池の歴史を思えば、実用化までたどりつくのはそう遠くない未来の話なのかもしれません
参考文献
"Recent progress and prospects of Li-CO2 batteries: Mechanisms, catalysts and electrolytes." Energy Storage Materials 34 (2021): 148-170.
"Li-CO2 and Na-CO2 batteries: toward greener and sustainable electrical energy storage." Advanced Materials 32.27 (2020): 1903790.
"Li-CO2 electrochemistry: a new strategy for fixation and energy storage." Joule 1.2 (2017): 359-370
"Lithium-CO2 batteries and beyond." Frontiers in Energy Research 11 (2023): 1150737