同素体(Allotrope)
周期表にはおよそ120種類の元素があります.原子レベルで見れば電子数や原子核数のわずかな違いでしかありませんが、マクロなサイズにつながった単体の性質は互いに大きく異なります.原子番号が1違うだけの炭素と窒素を見ても、一方は常温で固体、他方は気体と全く類似性を感じさせません.
元素それぞれに個性があるのは良いことですが、同じ種類の元素であっても同じものであるとは限りません.炭素原子そのものは全世界で共通ですが、炭素原子のみからなる単体であっても、互いに見た目も化学結合の様式も、構造も全く異なるものがあります.これを同素体と呼びます.
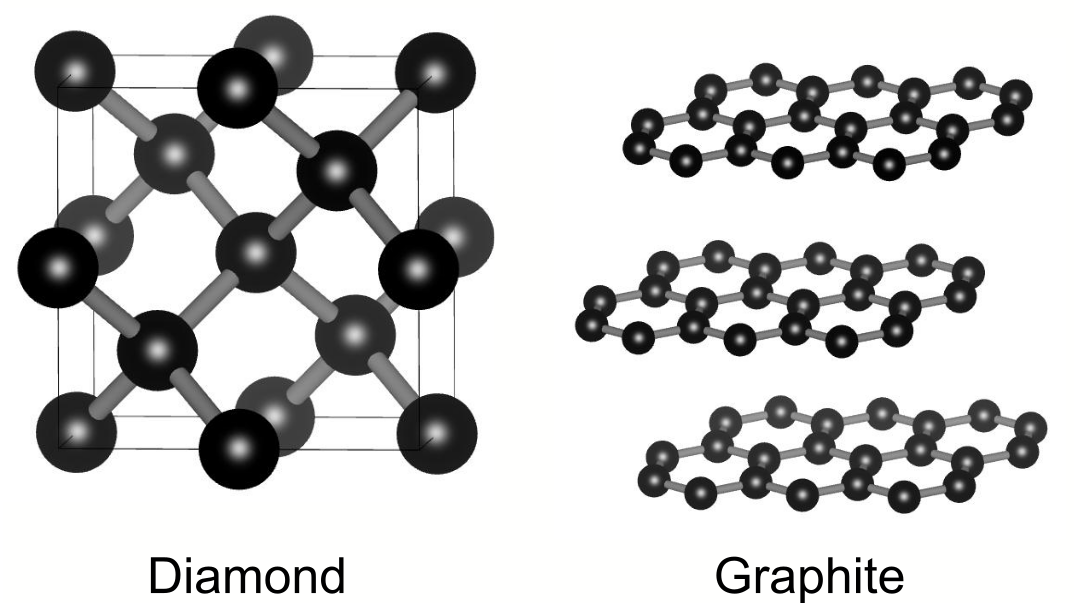
同素体の代表的な例は、ダイヤモンドとグラファイトです.互いに炭素原子のみからなる担体ですが、知っての通り両者は全く異なる見た目をしています.原子レベルで見ても両者の見た目は大きく異なりますし、物性に至っては全くの別物です.前者は物理的に硬い絶縁体であるのに対し、後者は柔らかい導電体です.
同じ元素から構成されるにも関わらず、何がこのような大きな違いを産むのでしょうか.また、炭素以外にはどのような同素体があるのでしょうか.同素体と似た意味を持つ用語として多形がありますが、それとの違いは何なのでしょうか.
今回は、基本的なようで意外と知らない言葉である同素体について見ていきます.なお、同位体とは何の関係もありません.
同素体の意味と歴史
同素体の定義は意外にも曖昧で、文書によっても異なる扱いがされています.辞書的な定義を見るために、デジタル大辞泉を覗いてみましょう.
「同じ種類の原子からなるが、原子の配列や結合のしかたが違い、性質の異なる単体」
これで全く問題ないようですが、実用上は疑問が残ります.例えば、水は温度によって氷(固体)、水(液体)、水蒸気(気体)と移り変わり、これらは互いに原子の配列が大きく異なっているわけですが、同素体とは呼ばれません.
一般に物質の三態による違いは同素体とは呼ばれないようです.明確な定義はないですが、「同じ温度や圧力などのとき」という条件を同素体の定義に加えるべきでしょうか.
また、同素体の定義は「単体」に限られたものであることにも注意が必要です.化合物で同じような振る舞いが見られても同素体とは呼ばれません.
そして、真にややこしいのが「多形」との区別です.上記の定義の上では、グラファイトとダイヤモンドは炭素の同素体です.一方で、ダイヤモンドの中にも立方晶ダイヤモンドと六方晶ダイヤモンドのように区別がありますが、これらは同素体というよりも多形と呼ばれることのほうが多くあります.
多形は結晶性物質に使われる概念で、同じ組成であっても結晶構造が異なるものを示す概念です.同素体との違いは、(結晶構造が変わっても)結合様式が大きく変わらない点と、(単体でなく)化合物であっても適用できる概念であるという点です.また、同素体は結晶性物質だけではなく分子であっても対象に含まれるという違いもあります.
以下に、B. D. Sharmaによる同素体と多形の定義をまとめます.
ややこしいですね.個人的にはどちらかの概念に統合してもう一方の概念は廃止してしまっても良いのではないかと考えます.
大抵の場合、ややこしい考え方があるときは、歴史的に概念に修正が繰り返されてきたという経緯があります.例えば税制のように.以下では、同素体という概念がどのように形作られてきたかを振り返ります.
同素体の歴史
同素体(Allotrope)という言葉を作ったのは、化学という学問自体の草分けと言えるJöns Jacob Berzeliusです.彼は、硫黄の単斜晶から菱面晶への相転移に関する研究をレビューする中で同素体の概念を提唱しました.
当時、組成が同じであるにも関わらず異なる物質の概念は異性体として既に知られていました.酢酸メチルとギ酸エチル(ともに)のように原子の配置が異なる異性体(metamerism)とエチレン(
)とブテン(
)のように組成比は同じでも絶対数が異なるもの(polymerism)です.
しかし、単斜晶と菱面晶の硫黄やグラファイトとダイヤモンドのように、単一元素からなる物質の2つの形態の差異は、既存の「異性体」の概念では説明できませんでした.
当時、Berzeliusを含めた多くの化学者は「元素は本質的に単原子である」と信じており、「元素には変化する内部構造がなく、その違いは原子そのものの性質に由来する」と考えていたためです.
そこで、Berzeliusは第三の異性体として同素体(allotrope)という新しい用語を提唱し、単一元素からなるにも関わらず異なる性質を示す物質の区別をつけました. この言葉はギリシャ語の άλλοτροπἱα(変わること、異なること)に由来します.
しかし、分子の存在さえ曖昧な時代に提唱された用語はその意味も曖昧になっていきます.有機化学の台頭した19世紀半ば、異性体の概念は立体異性体や構造異性体に細分化され、同素体は専ら無機化学でのみ使用される用語となりました.19世紀後半には、元素であろうと化合物であろうと、熱によって誘発される全ての変化(三態や構造相転移)を全てまとめて同素体と呼ぼうという提唱もありました.
アボガドロの仮説が受け入れられ、単一元素であっても分子や無機結晶のような構造体を形成できると知れた19世紀末になると、もはや単体にしか使えない「同素体」という言葉を使う意味も無くなってきました.多くの場合、「多形」の語と同等に扱われており、両者を区別する意味も無くなっています.
実際、1912年の時点でオストワルド法で有名なFriedrich Wilhelm Ostwaldは「(同素体と多形という)二種類の語を区別する理由はなく、一般的でない方の語は消え去ったほうが良い」と述べています.ところが、御存知の通り、同素体という言葉は今も教科書にありますし、IUPACによっても使用が支持されています.
代表的な同素体
様々な議論はあるものの、同素体という用語は基礎科学で学ぶ非常に一般的な用語であることは確かです.初学者にとって見れば、同じ元素であるにも関わらず全く異なる性質を示す同素体は化学を面白いと感じさせる(あるいはややこしくて嫌なものと感じさせる)ものでしょう.
様々な元素に同素体がありますが、以下では代表的なものを紹介します.
炭素
ダイヤモンドとグラファイトは代表的な炭素の同素体として知られています.高価な宝石であるダイヤモンドと単なる炭(グラファイト)が同じ元素からできているとは!
ダイヤモンドにおいて、炭素原子同士は共有結合によって三次元ネットワークを形成しています.この堅固な結合によりダイヤモンドは地球上に存在する物質の中でもトップクラスに硬く、宝石だけでなく切削工具としても盛んに利用されています.共有結合によって電子は局在しており、ダイヤモンドは絶縁体です.
一方、グラファイトは炭素原子が平面内に二次元のネットワークを形成しており、各層が分子間力によってゆるく束縛されています.層は簡単に剥がすことができ、これが黒鉛の軟らかさの由来です.黒鉛は面内では優れた電子伝導を示し、電極などで導電材料として利用されます.
グラファイトから炭素原子層を一層のみ取り出した物質がグラフェンです.面内で非常に優れた電子伝導性と熱伝導性を示し、基礎科学的にも応用的にも非常に重要な材料です.
他にも、炭素原子が一次元のチューブ状になったカーボンナノチューブ、サッカーボールの形をしたフラーレンなども有名です.炭素の同素体は非常に多いので、いつか個別項目で扱いましょうか.
酸素、窒素
常温ではともに2原子からなる分子の形で存在しています.燃焼によって大きなエネルギーを放出する酸素に比べて、三重結合を持つ窒素は化学的に非常に安定です.
酸素の同素体としては、三原子からなるオゾンが有名です.高圧下においては酸素の八量体が形成されるとか.マジかよ.
窒素においても同様に三量体や四量体分子が存在します.高圧下ではベンゼンのような六員環の窒素分子が形成されるのだとか.
硫黄などのカルコゲン元素
硫黄とセレンは16族に属する元素でありカルコゲンと総称されます.これらは同種元素間での一連の結合(カテネーション)が生じやすく、結合のネットワークのパターンに応じて多様な同素体が形成されます.
基礎化学で習うような直方硫黄(α硫黄)、単斜硫黄(β硫黄)、ゴム状硫黄などはその例です.セレンも結合パターンに応じていくつかの同素体があります.
リン
リンの同素体は何種類かありますが、それぞれ色が異なるため、色の名前をつけて呼ばれます.白リン、黒リン、紫リン、赤リンなどが挙げられます.黒リンは二次元的な構造を持ち高い電子伝導度を示すため、二次元デバイスに向けた研究が盛んです.
なお、自然発火することでおなじみの黄リンは、白リンの表面が微量の赤リンで覆われたものであり、同素体ではありません.まあ、色の見え方の問題なので好きに呼べば良いと思います.
シリコン、ゲルマニウムなどの14族元素
安定な結晶相のほか、アモルファスの状態で存在することもあります.また、グラフェンのように二次元の単原子層となったシリセン、ゲルマネンなどの状態も知られています.
種々の金属元素
鉄をはじめとして、多くの金属元素は製造方法や温度に応じて様々な結晶構造を示します.これらを同素体と呼ぶこともできますが、多形と呼ぶ方が一般的なように思います.
まとめ
同素体は、どの基礎化学の教科書にも載っているような基本的な用語です.しかし、化学の黎明期に生まれただけあり、現代ではわざわざ一つの用語を割くほどの必要があるかは議論の余地がある用語となっています.個人的な意見としては、元素にしか使えないという制限に特に意味もないし、実用上も多形と区別することがあまりないように思うので、どちらかに統合しても問題ないように思います.
しかし、元素が同じであっても異なる性質を示すことで、化学の多様性と奥深さを教えてくれる存在であることには違いありません.
参考文献
Jensen, William B. "The origin of the term allotrope." Journal of Chemical Education 83.6 (2006): 838.
Sharma, B. D. "Allotropes and polymorphs." Journal of Chemical Education 64.5 (1987): 404.
化学と教育 2022 年 70 巻 9 号 p. 434-437
CHEMISTRY & EDUCATION 2013 Volume 61 Issue 12 Pages 600-603
Berzelius, J. Unorganische Chemie: Isomerie. Jahres-Bericht 1841, 20, 7–13. Definition on p 13.
Ostwald, W. Outlines of General Chemistry; Macmillan: London, 1912; p 104.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).