Bond valence sum (BVS)
酸化物などイオン結合性の大きな物質では、構成要素である元素にイオンの価数(酸化数)を割り当てることができます.例えば、は
と表せます.
こうした酸化数の割当が、少なくとも過去に報告された類似の物質と比べておかしな値になっていないかを判断する手法の一つがBond valence sum (BVS)法です.これはポーリングの法則に基づいて考案されたものであり、結晶構造や酸化数の値が妥当なものか判断する基準となります.
ボーリングの第二法則によれば、安定なイオン結晶においては局所的な電気的な中性条件が満たされます.まず、n 価の陽イオン M が m 個のイオンによって配位されている状態を考えると、陽イオンの数の価数 n を m 個の結合それぞれに割り振ることができ、それぞれ n/m の結合原子価を持つと考えることができます.これは、結合一つあたりの酸化数のようなものです.
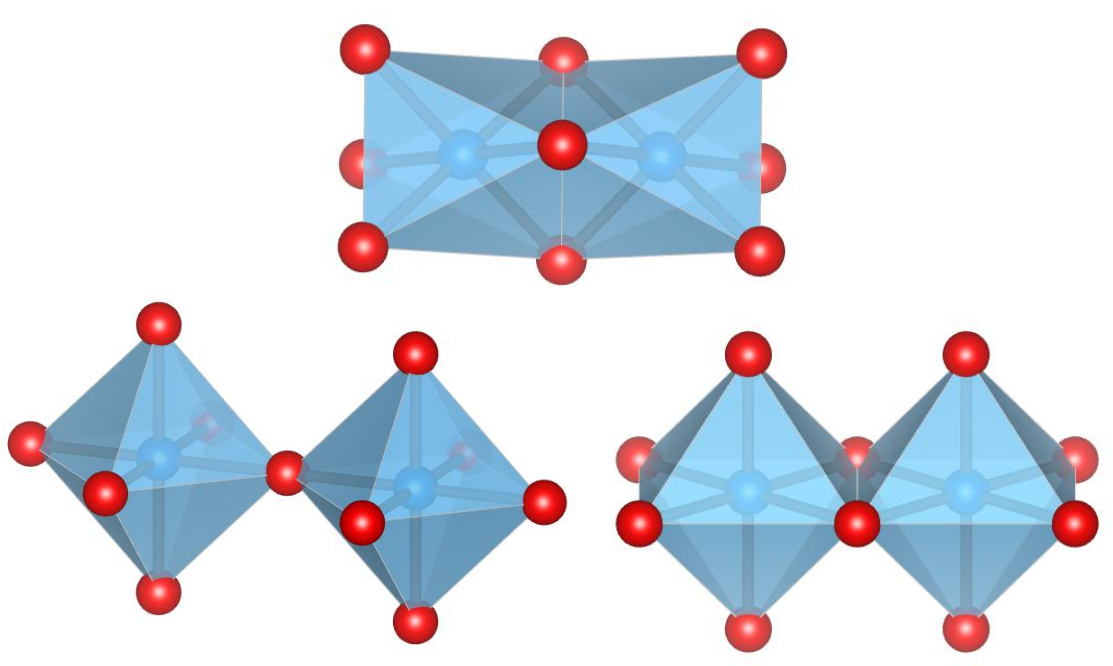
局所的な電気的な中性条件を満たすためには、結合原子価による電荷をイオンの電荷で打ち消す必要があります.ゆえに、あるイオン周りの結合原子価の和とイオンの酸化数を足し合わせるとゼロになります.これを利用すれば、結合原子価を計算して足し合わせることで中心イオンの酸化数を推定することができるようになります.
1985年にBrownとAltermattはイオン結晶一般に概念を拡張し、下式で表される結合原子価を提唱しました.
ここでは原子
の酸化数、
は原子
と
の結合長、
は経験的に求められた陽イオンと陰イオンのイオン結合長(Bond valence parameter)、
は定数で一般に0.37の値を持ちます.
これらの値を全ての結合について足し合わせることで、中心イオンの形式的な酸化数を求めることができます.
Bond valence sum の計算方法
実際に計算を行ってみましょう.イオン結合性の高い物質であれば何でもいいので、ここではを選びます.結晶構造を見るために必要なcifファイルはMaterials Projectなどから持ってきましょう.
続いて、計算に必要なBond valence parameterの提供元はいろいろなところがありますが、例えば以下のサイトで提供されています.
(IUCr) Bond valence parameters
では、
は6つの酸素イオンに配位されています.形式的な酸化数は4ですので、Bond valence parameterの対応する値を探します.
の値も忘れずに.数字がいくつかあったら、文献が新しい方を使えばいいのかな?
上式に従って計算は簡単で、4.042となりました.これは形式的な値に近い値です.使用するBVパラメータによって少し違う値になったかもしれません.
もう少し複雑な結晶構造でもやってみましょう.ではどうでしょう.同様に計算を行うと、5.785となりました.これも形式的な酸化数である6に近い値です.
以上のように、Bond valence sum法を用いることで形式的な酸化数を確認できます.これにより、例えば構造解析によって得られた結晶構造やデータベースにある結晶構造モデルが妥当かどうかの確認に使えます.あまりに不自然な値になった場合は、モデルの割り当てが間違っている可能性があります.
参考文献
"Bond valence sum: A powerful tool for determination of oxidation states of metal ions in coordination compounds." (2020).
"Recent developments in the methods and applications of the bond valence model." Chemical reviews 109.12 (2009): 6858-6919.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).