人工光合成
光合成は、植物が行う生命活動の一種であり、光エネルギーを化学エネルギーに変換して生体に必要な物質を作り出すプロセスです.植物は水と二酸化炭素を摂取し、複雑な反応経路を経て、最終的に酸素と糖を作り出します.
人工光合成の目標は、植物の光合成過程を理解し、人工的に同じ反応を起こすことです.二酸化炭素は地球温暖化の原因と言われ、排出量を減らすことが求められていますが、人工光合成が完成すれば二酸化炭素を人為的に大気中から取り除くことが可能です.
ただし、人工光合成のターゲットには二酸化炭素の分解だけでなく、光のエネルギーを転用して人類にとって有用な物質を合成する反応も含まれます.例えば、光エネルギーによる水の分解もその一つです.
水を分解して水素を作る
水分子は酸素原子と水素原子から構成されるので、水分解により酸素分子と水素分子が生成します.酸素はともかく、水素には強力な需要があります.水素は燃料として使用できるばかりか、燃焼しても有害な物質を発生せず水に戻るだけなので、非常にクリーンなエネルギー源です.
水素を簡単に供給できればよいのですが、天然に水素ガスは殆どなく、必要なら人工的に作り出す必要があります.現在、水素はほとんどが化石資源の分解により製造されていますが、この過程で二酸化炭素が発生しているので、水素がクリーン材料と謳ってもよいものか疑問が残ります.
私達が利用できる再生可能なエネルギー源には何があるでしょうか.無尽蔵に降り注ぐ太陽エネルギーはその一つです.太陽光を利用して水から水素を作り出すことができれば、究極のクリーン材料と呼べるでしょう.
太陽光による水分解の手段としては、太陽光発電から得た電力で水を電気分解する方法があります.しかし、システムが複雑であり、大規模応用の点ではまだまだ発展段階です.一方、光触媒による水分解では、水に分散させた光触媒粉末に光を照射だけの簡素なシステムから組み立てることができ、大規模応用に向いています.
とはいえ、光触媒による水素製造への道もまだ半ばです.光触媒の水分解の利用を妨げているのは、その低いエネルギー効率です.逆に言えば、エネルギー効率を解決できれば、夢のクリーンシステムが完成するに違いありません.
人工光合成と光触媒
光触媒による水の電気分解は、1970年代に酸化チタン単結晶を用いた光電極において実証されました.このいわゆる「本田・藤嶋効果」は、ちょうどオイルショックの時期と重なったこともあり、水素を直接製造可能な手段として大いに注目を集めました.しかし、エネルギー効率が思ったように上がらず、光触媒による水分解は長い間冬の時代を迎えることになります.
これは、光触媒による水分解はとても難しい反応であるため、思ったように効率が上がらなかったことに由来します.そのことを理解するために、どのようにして水分解が行われるかを見ていきましょう.
光触媒反応を起こす固体は半導体または絶縁体、すなわち、バンド構造にバンドギャップを持つ物質です.バンドギャップとは、電子がエネルギー的にとることのできないギャップであり、下側に位置する価電子バンドと上側に位置する伝導バンドを隔てます.

ここにバンドギャップ以上のエネルギーを持つ光を照射すると、価電子バンド上端の電子が伝導バンドの下端に遷移します.このとき、価電子バンドには電子の抜け殻(正孔、ホール)が残されます.伝導バンドに生成した電子は還元力を、価電子バンドに生成したホールは酸化力を持っており、それぞれが還元・酸化反応を起こします.
電子の還元力・ホールの酸化力次第では、水を分解して酸素と水素を生成する事が可能となります.
具体的に水が分解可能であるかどうかは、価電子バンド・伝導バンドの相対的な位置で決まります.バンド図で縦軸はエネルギーを意味しており、下に行くほど電子の居心地がいいことを意味します.電子が負の電荷を持っていることを考えれば、上に行けば電位が負に大きく(電子の居心地が悪く)なり、下に行けば電位が正に大きく(電子の居心地が悪く)なります.
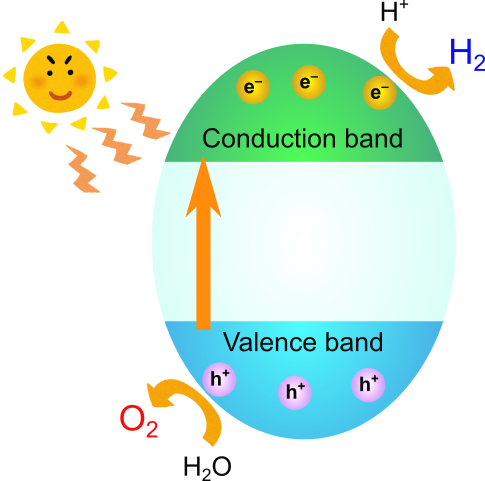
もし伝導バンドの下端が水素イオンの還元電位よりもマイナス側にあれば、電子が水素イオンを還元して水素が発生します.また、もし価電子バンドの上端が水の酸化電位よりも下側にあれば、ホールが水を酸化して酸素が発生します.
すなわち、半導体の価電子バンドと伝導バンドが水の酸化還元電位を挟み込む形になっていれば、水を電気化学的に分解するポテンシャルがあることを意味します.ゆえに、ちょうどいいバンド構造をもつ半導体材料を選ぶことで、水を水素と酸素に変換することが可能となります.
言われてみれば当たり前の反応のように聞こえるでしょうが、この反応は全く自明ではありません.光によって電子とホールが首尾よく生成したとしても、これらのキャリアに待ち受ける運命は過酷なものです.
光を吸収した後のこと
バンド図で見ると電子とホールはバンドギャップを隔てて遠くに行ってしまったように感じますが、実際は空間的な距離は全く変わっていません.すると、電子とホールはクーロン力によって引き合うので、すぐに再結合して元の状態に戻ってしまいます.
電子とホールによる酸化・還元反応を成功させるには、電子とホールがお互いに出会わないように表面まで誘導する必要があります.また、表面にたどり着いても、ぐずぐずしていると異符号のキャリアに追いつかれてしまいますから、酸化(還元)反応も可能な限り速やかに行わなくてはなりません.
これだけの障害をくぐり抜けることで、ようやく光触媒による水分解が達成されるわけです.
効率的な水分解を起こすために、まさに職人芸と言うべき創意工夫がこれまでなされてきました.例えば、光生成したキャリアによる反応を促進するため,半導体粒子は助触媒と呼ばれる微粒子で修飾されます.また、結晶中の欠陥はキャリアが出会うスポットになりやすいため、欠陥の少ない試料を調整することも求められます.
水分解の反応と効率
光による水の分解は、以下の式で表されます.
この反応は自発的に進まない(コップの水が勝手に水素ガスに変わっていったら困りますよね)ため、光によるエネルギーと光触媒の特殊なバンド構造によって無理やり反応を促進させているのです.
この反応に必要なエネルギー()は、およそ1000 nmの波長の光が持つエネルギーに相当します.この光は近赤外光の領域に相当し、これよりも短波長な光を水分解に使用することができます.100%の量子効率で太陽光を余すこと無く使用すれば、エネルギーの変換効率は約48%にまで達します.
しかし、このように高い変換効率は実際には困難です.一つの理由は、代表的な光触媒材料である酸化チタン()などの酸化物が、紫外光しか吸収できないからです.紫外光は太陽光エネルギーの成分中で僅かであり、紫外光のみを用いた反応では太陽光エネルギー変換効率は高々2%程度にとどまります.
太陽光の大部分を占めるのは我々の目に見える「可視光」であり、全体の50%程度を占めます.光触媒の吸収波長を可視光域まで拡大することで、理論上のエネルギー変換効率が大幅に上昇します.
では、可視光に応答する光触媒材料を使用すれば事足りるように思えますが、実際には可視光による水分解は非常に困難な課題でした.
可視光による水分解
なぜ可視光による水分解が困難であるのか、バンド図に戻って考えましょう.半導体のバンドギャップの両端が水の酸化還元電位を挟み込む位置にないと水を分解できないのでした.
光触媒材料として理想的なのは、化学的に安定な酸化物材料です.酸化物の価電子バンドはほとんどが酸素の軌道から構成されています.これは、酸化物では酸素が陰イオンとなっており、酸素のp軌道が電子で埋まっていることを考えれば理解できます.
このことは、金属を変えて様々な酸化物を調整しても、酸化物である限り価電子バンドの上端は変化しないことを意味します.
酸化物の価電子バンドは、水を酸化するには十分な位置にありますが、やや下にあり過ぎます.この状態で伝導バンドを、水の還元が可能なように配置するとバンドギャップが3.0 eVを超えてしまい、可視光を吸収できなくなります.逆に、可視光を吸収できるような酸化物を用いると、水の還元に十分な伝導バンドをもつことができなくなります.
まさにデッドロック.
しかし、ここから新たな方策も見えてきます.酸化物を使わなければ良いのでは、と.実際、などの硫化物は可視光応答に適したバンド構造を持ちます.しかし、光触媒反応では強力な酸化力をもつホールは、光触媒自身にも降り注ぐことを忘れてはいけません.
光照射によって生成したホールは、不安定な硫化物イオンを容易に酸化してしまい、表面にキャリアがたどり着かないどころか光触媒自体を破壊してしまいます.窒化物などにおいても同様です.酸化物でこのようなことが起こらないのは、酸素の電気陰性度が大きく、酸素イオンが容易には酸化されないためとされています.
可視光による水分解を成し遂げるためには、「水の酸化還元電位を挟み込むようなバンド構造を持つ」「可視光が吸収できる程度の狭いバンド構造を持つ」「ホールによって自己分解しない程度に安定である」ような物質が求められます.
非常に注文が多いですが、そんなことを実現できるのでしょうか.驚くことに、無茶な注文に応える方策がいくつも考え出されています.
価電子バンドを作り変える
安定性を保ちながら、価電子バンドを押し上げる方策として、複数の陰イオン種を含むような物質の利用が考案されました.酸素イオンと窒素イオンを含む酸窒化物などが代表例です.
酸素よりも電気陰性度の小さい陰イオン種(窒素など)を酸化物に混ぜ合わせることで、価電子バンドをマイナス側にシフトさせることができます.これにより、バンドギャップを小さくしたうえで、水を分解可能な光触媒が利用できると考えられます.また、あくまで中心は酸化物であるため、酸化物イオン由来の化学的安定性にも期待できます.
実際に、酸素と窒素からなる酸窒化物、酸素とハロゲン元素からなる酸ハロゲン化物、酸素と硫黄からなる酸硫化物などで可視光による光触媒反応が起こることが報告されています.
また、陰イオンではなく陽イオンを利用して価電子バンドを押し上げる方法も知られています.鉛やビスマスといったpブロック元素は、陽イオンとなった時にs軌道の電子を孤立電子対として保持する場合があります.この孤立電子対と酸素イオンが相互作用することにより、価電子バンドのエネルギーが引き上がる現象(リバイスドローンペアー効果)も報告されています.
2種類以上の光触媒を利用する
上述のように、1つの光触媒で可視光を用いた水分解は困難でした.1つでだめなら2つ使えばいいじゃないかという発想から「二段階励起型水分解システム」が考え出されました.

実は、植物の光合成は二段階の光励起機構であるZ-スキームによって行われています.このスキームでは、可視光のエネルギー不足を補うため、2段階の光励起によって高いエネルギーを引き出しています.図のように電子の励起過程がアルファベットのZを横向きにしたような模式図で記述されるため、Zの名がついています.
「なんでNスキームじゃなくてZスキームなの?」というツッコミは野暮ですが、自然界に存在する仕組みを光触媒系で人工的に作り出すことが可能です.ここでは、水素生成用と酸素生成用の二種類の光触媒を同時に使用することで可視光による水分解を実現します.
この過程では、水の酸化還元に寄与しない邪魔な電子(ホール)が生成しますが、それらは適切な酸化還元対を液中に用意することで「処分」します.すなわち、水素生成用の光触媒から出た電子と酸素生成用の光触媒から出たホールを無くし、水分解に必要な電子・ホールのみを残します.
このようなシステムの利用により、水分解に様々な可視光応答光触媒の利用が可能になります.例えば、は水素発生反応に用いることができませんが、Zスキームの酸素生成用途に使用できます.様々な組み合わせに基づき、数十種類の系で可視光水分解が達成されています.
まとめ
水素社会という言葉が流行って久しいですが、肝心の水素の入手法には困難が伴います.地球上に存在する水素源は水か炭化水素であり、後者が有限な化石資源であることを考えれば、ほぼ無尽蔵の水を利用できることの意義は大きいです.しかし、水の分解のために化石資源を燃やしていては本末転倒なので、太陽光という無尽蔵のエネルギーを利用することの意義もまた大きいです.
光触媒による水分解は可視光の利用を成し遂げ、新たなフェーズに移行しています.昔は効率が低く、「木を植えたほうがマシ」な状況だったようですが、最近では量子効率が100%に近い材料が開発されるなど徐々に改善しています.また、100 m2規模の大規模なパネル反応器を用いて数か月にわたる水素製造実証することも可能になっており、産業利用までの道が着々と整えられています.
参考文献
表面科学 2017 年 38 巻 6 号 p. 274-279
応用物理 2014 年 83 巻 2 号 p. 112-115
応用物理 2018 年 87 巻 6 号 p. 402-408
Electrochemistry 2014 年 82 巻 6 号 p. 486-491
Electrochemistry 2014 年 82 巻 6 号 p. 492-496
日本結晶学会誌 2018 年 60 巻 5-6 号 p. 260-267
化学と教育 2011 年 59 巻 6 号 p. 314-315
化学と教育 2019 年 67 巻 11 号 p. 526-529