過酸化物(Peroxide)と亜酸化物(Suboxide)
酸化物とは、酸素原子が他の元素と結びついてできた化合物を指します.例えば、日常的に目にする錆びた鉄やコンクリート、陶磁器やガラスも酸化物の一種です.総じて丈夫かつ扱いやすく安定な酸化物は、生活において必要不可欠です.
酸化物中で酸素は2価の陰イオンとして振舞うため、当然、相方の元素は陽イオンとして存在します.陽イオンの取りうる価数は元素ごとに決まっており、例えば、は1価、
は2価、
は2価または3価の陽イオンであるのが最も安定です.よって、陽イオンの種類と数が決まれば、生成する酸化物中に含まれる酸素イオンの数も自ずと決まってきます.
ところが、酸化物の中には、通常想定されるよりも多くの、あるいは少量の酸素を含む物質が存在します.過酸化物は、酸素が通常よりも多く含まれている化合物で、その強力な酸化力が特徴です.や
などが代表例です.
対照的に、亜酸化物は酸素が通常よりも少ない状態で存在する化合物であり、や
などの物質が知られています.
過酸化物と亜酸化物は、通常の酸化物とはまた異なる特徴があり、様々な分野で利用されています.今回は、ちょっと変わった酸化物の世界を見ていきます.

過酸化物
は通常、2価の陽イオンとなります.そのため、
の酸化物として思いつくのは
のみですが、実際には
という物質が存在します.
が4価というのは考えにくいので、酸素の方に何か秘密があるはずです.
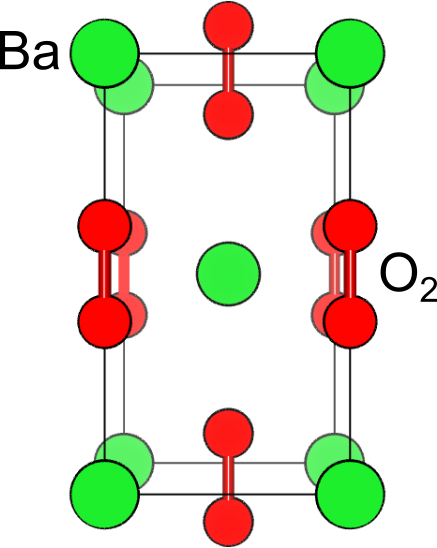
の結品構造を見ると、2つの酸素原子が非常に近い位置に位置しています.これらの酸素原子は共有結合を形成しており、全体として2価
の陰イオンとして振舞います.
通常の酸素分子では、酸素が持つ6つの価電子のうち4つが孤立電子対に、2つがもう一方の酸素との共有結合に使われており、全体として中性です.一方、過酸化物における酸素分子では、共有結合に使われている電子は1つのみです.このままでは電子が1つ余ってしまうので、酸素1つあたり1つの電子をもって1価の陰イオンとなることで帳尻を合わせます.
ブリタニカ百科事典では、このような酸素の二量体を含む物質を過酸化物と定義しています.そのため、過酸化物は固体物質に限った概念ではなく、分子においても見られます.通常、式で表され、
および
は水素または有機基です.最も有名な過酸化物はおそらく過酸化水素でしょうが、これは両端の水素原子に挟まれるように
二量体が位置しています.
その名の通り、過酸化物は金属や金属酸化物を強力な酸化条件で過剰に酸化することによって得られます.最大の特徴である結合によって、過酸化物は独特の反応性を示します.“過”と名につくように過剰な酸素は反応性が高く、過酸化物は相手を酸化する強力な酸化剤として機能します.お察しの通り不安定で、扱いには注意が必要です.
代表的な過酸化物およびその性質
過酸化水素
“過酸化”と名のつく物質の中でも最も有名な物質と思われます.水溶液はオキシドールと呼ばれ、強力な消毒剤および漂白剤として家庭でもよく使われます.また、様々な産業プロセスにおいても重要な役割を担っている物質です.珍しいところでは、酸素を放出する性質を活かして、ロケット工学の推進剤としても使用されています.
アルカリ金属あるいはアルカリ金属の過酸化物
など種々の過酸化物が知られています.いずれも強力な酸化剤や漂白剤として使用されるほか、容易に分解して酸素を放出します.
有機過酸化物
過酸化ベンゾイルなどの有機過酸化物は、重合プロセスやにきび治療にも使用されます.
超酸化物
過酸化物のもっと極端な例として超酸化物があります.過酸化物と同じように構造中に酸素分子を含みますが、酸索2つで1価の陰イオン、すなわちを持ちます.この酸素ユニットは超酸化物イオン、あるいはスーパーオキシドアニオンと呼ばれます.
超酸化物の最大の特徴は、酸素が不対電子を持つことです.すなわち、電子の磁気モーメントが相殺されておらず、全体として磁石の性質()を示します.世にも珍しい酸素のp電子由来の磁性です.
アルカリ金属を含む超酸化物などは低温で反強磁性秩序を示します.中でも
は一次元反強磁性としての性質を示すということで、特に注目されています.
亜酸化物
過酸化物の反対であり、“亜”を名に冠すことから酸素が足りない物質であると予想できます.組成式中の金属元素の数が酸素よりも多いものを亜酸化物と呼ぶようです.
例えば、通常の酸化物ではや
のように金属元素の数は酸素よりも少ない、あるいは同じ数になりますが、亜酸化物では
のように酸素の方が少なくなります.
亜酸化物では、酸素でない方の元素にどのような価数を当てはめればいいか困ります.
例えば、を含む酸化物では
が有名であり、その他の化合物においても
は3価が安定です.一方、
という物質が存在しますが、この物質内の価数はどのように考えればよいでしょうか.通常よくある価散では割り振ることができません.
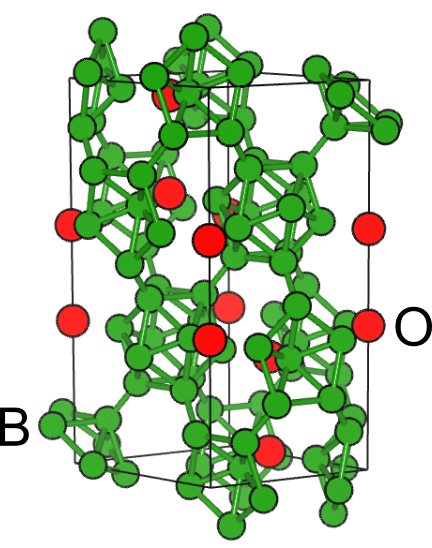
結晶構造を見てみると、同士が結合を作っていることが分かります.このように亜酸化物では、酸素ではない元素同士が化学結合を形成することで、酸素が足りない部分を補っています.
言い換えれば、過酸化物における酸素分子と同じように、酸素以外の原子が分子あるいはユニット(クラスター)を形成することで1原子当たりの価数を下げ、少ない酸素数でも安定に存在できるようになります.
過酸化物と比べると、亜酸化物にはあまり馴染みがありません.しかしながら、基礎科学的には興味深い研究対象です.過酸化物の反対であることから、酸素を吸収する還元剤として機能しそうな気もしますが、そうした話はあまり聞きません.おそらく、酸素を構造中に取り入れるためには、他の原子のダイナミックな移動が必要で、反応性としてあまり高くならないのかもしれません.
代表的な過酸化物およびその性質
アルカリ金属の亜酸化物
など多くの亜酸化物が知られています.構造中の特徴は、アルカリ金属同士の距離が近く、いくつかの金属によるクラスターが見られることです.こうしたクラスターのすき間に酸素が位置しています.
東北大学の山根先生は、多くの亜酸化物を合成し報告しています.例をあげると、です.
一連の物質では、金属元素同士がクラスターを組んでいる様子がうかがえます.物性という観点では今のところ目立ったものが無いように思えますが、少なくとも構造的には珍しいので、新しい機能が見つかってもよいのではないかと期待しています.
まとめ
世の中にはいろいろな酸化物があります.酸化物といえば安定なイメージですが、中には極めて不安定で、常温で簡単に分解してしまうものもあります.不安定なことは反応性が高いということの裏返しで、反応性の高い過酸化物は酸化剤や漂白剤として生活に根付いて使われ続けています.過酸化物と比べて亜酸化物は物質の報告数も応用例も少ないように感じます.ポテンシャルはあると思うので、これからの研究の発展を楽しみに待ちましょう.
参考文献
"Ternary Suboxides Ti7Ga2O6, Ti3GaO, and Ti5Ga3O." Inorganic Chemistry 57.16 (2018): 9941-9948.
"Synthesis of suboxides, Ti8 (SnxBi1− x) O7 and Ti11. 17 (Sn0. 85Bi0. 15) 3O10, using a Bi flux and their crystal structures." Journal of Alloys and Compounds 701 (2017): 967-974.
"Synthesis and Crystal Structure of Suboxide Solid Solutions, Ti12− δGa x Bi3–x O10." Inorganic Chemistry 56.19 (2017): 11610-11618.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).