混成軌道(Hybrid Atomic Orbital)
混成軌道(ハイブリッド軌道、hybrid orbitals)とは、原子内の電子の振る舞いを説明するために量子化学で用いられる概念です.原子中の電子は、原子核の周りの特定のエネルギーを持つ領域(軌道)にあり、どの軌道に電子があるかによって原子の化学的性質や結合状態が決まります.
原子軌道として、主にs軌道、p軌道、d軌道、f軌道の4種類が知られています.s軌道は球形、p軌道はダンベル型、d軌道とf軌道はより複雑な形状をしており、電子が存在する確率が高い領域を表しています.
混成軌道は、これらの基本的な原子軌道の組み合わせによって得られる新しい軌道です.この概念は、化学結合の形成の際に、電子の配置が再編成され、エネルギー的により安定な状態を取ることを説明するために導入されました.
混成軌道の概念は大学化学の初等過程で導入され、化学の学術領域で当たり前のように使われます.しかし、その存在を全ての化学者が受け入れてきたわけではありません.
混成軌道は果たして実在するのか.今回は、混成軌道の概要からはじめ、その概念への批判、そしてその反論を見ていきます.
混成軌道の種類
混成軌道として、sp混成、sp2混成、sp3混成の3種類が知られています.
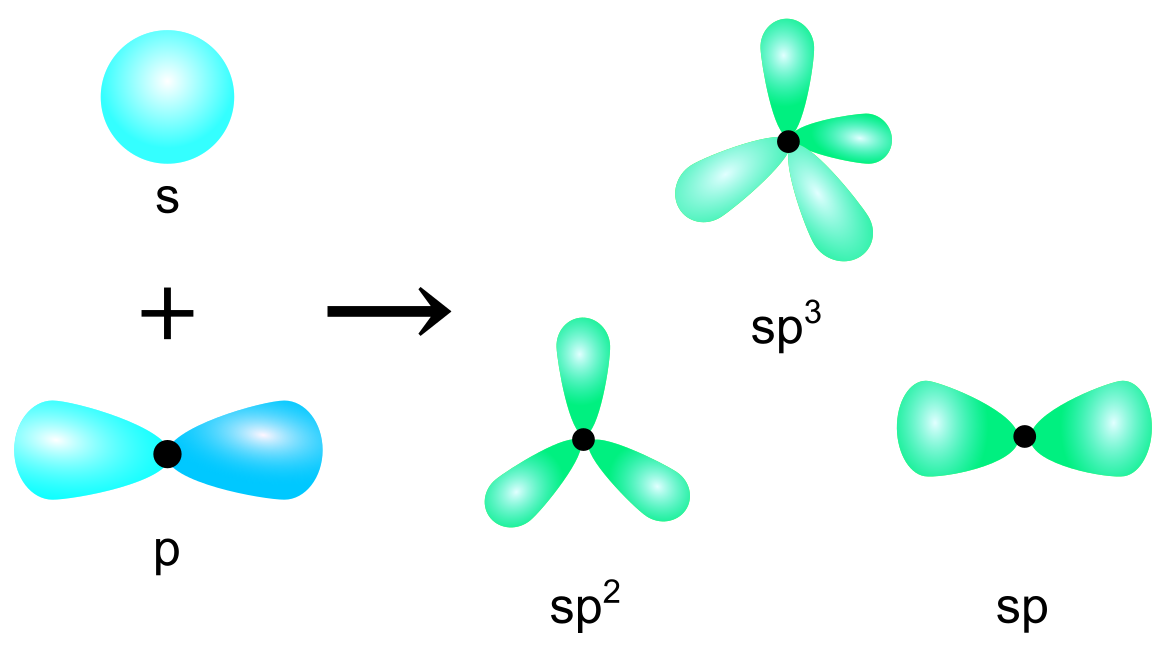
sp 混成軌道
1つのs軌道と1つのp軌道が組み合わさることで2つのsp混成軌道が生成します.これらの軌道は180度の角度で配向しており、直線型の分子構造を持つ分子、例えば二酸化炭素()で見られます.
sp2 混成軌道
1つの軌道と2つのp軌道が組み合わさって形成され、3つのsp2混成軌道が生成します.これらは120度の角度で互いに配向し、例えばエチレン()で見られます.
sp3 混成軌道
1つのs軌道と3つのp軌道が組み合わさり、4つのsp3混成軌道が生成します.これらは互いに約109.5度の角度で配向し、正四面体の分子構造を持つ分子、例えばメタン()で見られます.
混成軌道への批判
混成軌道の理論は、分子の形状や結合の方向性を予測するのに非常に有用ですが、実際の電子の振る舞いはもっと複雑であり、混成軌道はモデルの一つに過ぎません.より正確な電子の振る舞いを理解するためには、分子軌道理論や密度汎関数理論(DFT)などのより高度な量子化学的手法が用いられます.
混成軌道の概念の始まりは、ライナス・ポーリング(Linus Pauling)の時代にさかのぼります.ポーリングはメタンなどの分子の形状を理解するために混成軌道の概念を導入し、理論体系を構築しました.化学者にとって、混成軌道は合理的な考え方に思えました.
しかし、その時代に考案されたモデルが後世においても合理的であるとは限りません.実際、混成軌道が実在するか否かをめぐって議論が交わされてきました.
Alexander Grushowは、"Is It Time To Retire the Hybrid Atomic Orbital?”と題されたエッセイを発表し、混成軌道の概念を、そしてそれを初等教育で教えることを痛烈に批判しました.[1]
Is It Time To Retire the Hybrid Atomic Orbital?
まず彼が指摘したことは、光電子分光などの実験手段から混成軌道の証拠が見つかっていないことです.また、局在電子のみを考える混成軌道の概念は現代の量子力学の知識とはかみ合わず、非局在化した電子を考慮したモデルを使うことが必要であると指摘しました.以上より、初等教育で混成軌道を教えるべきではないと主張します.
さらにGrushowは、混成軌道が初等教育で使われている理由として挙げられている3つの主張を取り上げ、順番に反論していきました.
1.混成軌道は、分子の三次元構造(特に有機物)を理解するために役立つ
2.混成軌道は、特定の分子中心(通常は炭素)の周囲に結合した原子の向きを記述し予測するために有用である
3.混成軌道は、メタン中の4つの結合が等価であることを裏付ける
これらの主張に対し、
1.初学者には、混成軌道の概念を通り一遍ではなく本質的に理解することは難しく、原子軌道の概念を理解することと大して違いがない
2.VSEPRとルイス構造によっておおよその形状は予測でき、わざわざ混成軌道の概念を導入する意味合いが薄い
3.メタンの4つの結合が等価であることは混成軌道を用いることなく説明できるし、混成軌道では結合が等価であるためのエネルギー的な根拠を示していないこと
を理由として反論しています.
Grushowは、混成軌道を教えないのであれば、代わりに何を用いるべきかについても提案を行っています.
まず、分子の三次元構造を視覚化する際には、VSEPRを用いればよく、軌道の概念を一切用いることなく分子構造を記述できるとしています.実際、混成軌道は有機化学でこそよく用いられますが、登場する原子の種類が増える無機化学ではうまく機能せず、使われることはほとんどありません.このことは、混成軌道の適用対象が非常に限られた範囲にあることを意味しています.
また、電子が局在している前提に基づく混成軌道モデルと、2原子の間以外にも電子の存在確率が存在するという実際の量子力学の概念との間にはギャップがあります.よって、局在軌道のみが存在するという概念に基づいて初等教育を行っては、化学の深い理解が困難になるのではないかと主張します.実験的な裏付けのない混成軌道を詳しく説明するのではなく、軌道エネルギーについては量子力学的な説明を含む、より上級のコースに任せるべきであるという主張です.
以上は、混成軌道に対する批判ですが、この「批判」に対する批判も展開されています.
Grushowのエッセイの翌年、C. R. Landisは、Comments on "Is It Time To Retire the Hybrid Atomic Orbital?”として、Grushowの主張への反駁を行っています.ここではどのような主張がなされていたでしょうか.[2]
Comments on "Is It Time To Retire the Hybrid Atomic Orbital?”
Landisは、そもそも Grushowの主張のほとんどが未検証であり根拠がないと主張しています.
Landisによれば、局在電子モデルが電子密度分布を正確に表現できないということは、根拠のない主張です.「Valency and Bonding」によれば、局在化した自然結合軌道(NBO)混成軌道によるメタンの定量的記述が、1粒子密度行列によって表される電子密度分布を、99.95%を超える精度で記述できています.他の単純な分子についても同様です.
さらに、芳香族についても簡単な共鳴構造を追加することで、全電子密度を記述可能です.また、メタンに対する実験的な光電子分光の結果も、混成軌道の概念で十分に説明可能であると主張しています.
このように実験的にも理論的にも混成軌道は決して「誤った」記述ではないため、初等教育で扱うことに何も不都合はないとしています.むしろ、最終的に量子化学的な化学結合を理解するうえで極めて有用であり、決して理解を阻害するものではありません.確かにVSEPRヤルイス構造だけでも分子構造は予測できますが、ともすれば単なる暗記と化してしまう可能性があり、それよりは混成軌道を用いて軌道の概念に親しんでおく ことで直観的な理解が進むはずであると述べます.
まとめ
混成軌道の概念は化学の初等教育で必ず習う概念であり、メタンなどの有機分子の構造の起源を考える上での出発点となります.高校化学から移ったばかりのころは唐突な概念に戸惑うこともありますが、初学者の段階を過ぎてもなお化学の直観的な理解を助けてくれる便利な考え方です.
一方で、なぜ混成が行われるかなど、自明でない事柄も多く、使用には注意が必要です.当たり前と思うのではなく、「本当に必要な概念なのかな」と改めて考え直してみることも必要かもしれません..
参考文献
[1] Grushow, Alexander. "Is it time to retire the hybrid atomic orbital?." Journal of Chemical Education 88.7 (2011): 860-862.
[2] Landis, C. R., and F. Weinhold. "Comments on “Is it time to retire the hybrid atomic orbital?”." Journal of Chemical Education 89.5 (2012): 570-572.