更新 2024-3-1
二酸化チタン(TiO2, titanium dioxide)
地球上の資源のほとんどはいつか消費される運命ですが、宇宙から降り注ぐ太陽エネルギーは人類が滅亡してもなお尽きることのない事実上無限の資源です.太陽エネルギーのわずか数%でも利用できれば人類の消費エネルギーの大幅な削減が可能と言われ、太陽光発電をはじめとした太陽エネルギー利用が活発に進められています.
二酸化チタン()は古くは白色顔料として使用されていましたが、知名度が向上したのは「光触媒」作用が発見されてからです.「光触媒」とは光によって化学反応を促進可能な作用であり、無限の太陽エネルギーを産業に有効利用できるクリーンエネルギー材料の切り札です.
時は1970年代初頭.いわゆる「オイルショック」が起き、世界中の国々は化石燃料から脱却する方法を模索していました.そんな折の1972年、二酸化チタン()と白金からなるセルに紫外光を照射すると、水が水素と酸素に分解される現象が報告されました.
言うまでもなく水素は燃焼しても二酸化炭素を発生しないクリーン燃料の筆頭です.そんな水素が「水」と「光」から生成できるという反応は世界中の注目を集めました.
光触媒の仲間が増えてなお、は光触媒の代表として君臨しています.
は安価、安定、無毒であり、産業的に利用する上でのメリットが大きいです.残念ながら光触媒を用いた水分解はまだ実用化の水準に達していないものの、
の殺菌作用や超親水性を生かした環境浄化分野で威力を発揮しています.
現在、二酸化チタンは塗料、インク、食品添加物、化粧品、医薬品として使用され、日常生活でも身近な存在です.
二酸化チタン(TiO2)の結晶構造
酸素のほうがよりも電気陰性度が高いため、
はイオン結合性の化合物です.一口に
と言っても、該当する結晶構造には3種類あります.
アナターゼ、ルチル、ブルッカイトと呼ばれるそれぞれの結晶構造は互いによく似ており、全ての結晶構造においてイオンは6つの酸素イオンに八面体型に配位されています.一方、それぞれの酸素イオンは3つの
イオンと結合しています.

ルチル構造は正方晶系であるのに対し、アナターゼとブルッカイトは斜方晶系です.ルチルでは、酸化物アニオンは歪んだ六方最密充填で配置されていますが、アナターゼでは立方最密充填に近く、ブルッカイトでは「二重六方最密充填」です.ルチル構造は、や
などの他の金属二酸化物や二フッ化物にも広く見られます.
は、自然界ではルチルやアナターゼという鉱物として存在します.ルチルが最も安定な相であり、アナターゼやブルッカイトを高温まで加熱するとルチル相に転移します.高圧でのみ存在する多形を含めると、
には10種類以上の結晶構造が存在することが知られています.
酸化チタン( )の性質と利用
)の性質と利用
(1)顔料、塗料としての利用
は20世紀初頭から大量生産され、白色顔料として使用されてきました.明るく、高い屈折率を持ち、毒性がなく、安価な
は顔料として理想的です.
は全顔料の3分の2に使用されているとも言われ、塗料、コーティング、プラスチック、紙、インク、食品、サプリメント、医薬品に使用されています.その他、日焼け止めの用途としても利用されています.
(2)光触媒
「光触媒」という言葉は1911年に生まれましたが、目立った応用先もなく大して注目されませんでした.
1967年、本多健一氏と藤嶋昭氏によって、紫外光照射下の酸化チタンと白金電極間で水が分解され、酸素と水素が発生する現象が発見されました.この「本田・藤嶋効果」は1972年にNature誌で発表され、酸化チタンを用いた光触媒の研究が世界的に行われることとなります.
光触媒の主な用途は、太陽エネルギーを利用した物質変換(水、雑菌などの分解)であり、主にルチル相とアナターゼ相の酸化チタンが使用されます.酸化チタンはバンドギャップが大きく、アナターゼ相(3.20 eV)とルチル相(3.02 eV)では太陽エネルギーの5%しか吸収できません.
ルチル相に比べてアナターゼは安定性が劣りますが、アナターゼのナノ結晶は表面積が大きく、活性サイトが多く存在し、酸化還元能力が高いため光触媒用途にはアナターゼの方がよく使用されます.
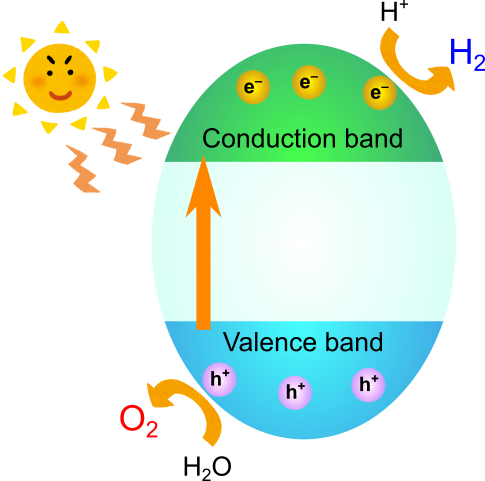
は、そのままではエネルギーギャップの大きな絶縁体であり、電気が流れません.
の伝導バンドは主に
の3d軌道、価電子バンドは
の2p軌道から構成されます.
エネルギーギャップ以上のエネルギーの光をに当てると、価電子バンドの電子が伝導バンドに遷移し、伝導バンドには電子が、価電子バンドには電子の空孔(正孔、ホール)が生成します.
電子・正孔のペアはの表面に拡散し、表面に吸着した物質と酸化還元反応を起こします.この酸化還元反応により、例えば水中の水素イオンは還元されて水素となり、水は酸化されて酸素が発生します.
ところが現実の反応はそう単純ではありません.生成した電子・正孔のペアの運命は過酷なものです.
電子と正孔は当然ながら互いに引き合って再結合しようとしますが、そうなると表面までたどり着けません.電子と正孔が出会わないようにうまく表面まで誘導してあげることで、はじめて表面で酸化還元反応を起こすことができます.格子の欠陥サイトは電子と正孔が出会う場所になりやすいため、欠陥の少ない試料を調整することが重要です.
電子と正孔が出会うこと無く表面にたどり着けるように、粒子の形態を変えたり、粒子の表面に金属や金属酸化物を付着させたり、に金属イオンや陰イオンをドープすることが行われています.
こうして表面にたどりついた電子と正孔は表面に吸着した水や酸素と反応して各種の活性種を生成させ、ほとんど全ての有機物を酸化して、水と二酸化炭素まで分解することが可能です.
この強い酸化力を利用し、油汚れや雑菌を除去する環境浄化への用途が進んでいます.
(3)超親水性
紫外光照射下で生成した電子・正孔のペアが酸化チタン自体の表面に作用し、表面構造そのものが変化する不思議な現象が報告されました.
に紫外線を照射すると、表面が徐々に親水化していき、最終的に親水性の非常の大きい「超親水性」状態が実現します.
親水性は、水とのなじみ易さを表した値です.
「なじみ易さ」の大きい物質を親水性、小さい物質を疎水性であると言います.疎水性は表面に水滴が付きやすくなるので、窓や鏡を「曇らせる」原因になります.親水性は水滴と材料表面の接触角で定義され、接触角が小さいほど親水性が高いとされます.
紫外光照射下の酸化チタンは接触角が0°の超親水性であり、表面で水滴は膜状になって広がります.このため、ガラスや鏡に酸化チタン薄膜をコーティングすることで、防曇・防滴性を付与することが可能です.
のコーティングにはセルフクリーニングの機能もあります.
多くの汚れは有機物由来であり、水に溶けないことから水で洗い流すのが困難です.しかし、コーティングがあれば、水が汚れ
の間に入り込み、汚れを浮き上がらせることによって、汚れを容易に洗い流すことが可能となります.
は光によって光触媒効果と超親水性を獲得しますが、暗い場所ではもとの状態に戻ります.このことから、
は太陽光が十分に当たる屋外で使用する必要があります.
二酸化チタン( )の関連材料
)の関連材料
酸化チタンには二酸化チタン()だけでなく、酸素量の異なるいくつかの物質が知られています.
は一般に
型構造を持ちますが、チタンと酸素の欠損量に応じて5種類の多形が存在します.
はコランダム(
)型構造を持つ半導体です.
は4価、
は3価のTiイオンを含みますが、価数が3と4の間の
イオンを持つ
の一般式を持つ酸化物が多く知られています.これらはマグネリ相と呼ばれ、複雑な結晶構造と金属絶縁体転移をはじめとした多様な物性を示します.
まとめ
酸化チタンは鉱物として古くから知られ、宝石や顔料としての利用が盛んでした.安全・安定・安価かつ優れた機能性を持った酸化チタンを利用しない理由はなく、今後も多種多様な用途で生産・利用が進んでいくと期待されます.
有機物分解作用と超親水性はコーティング材料としてうってつけの特性であり、環境浄化の用途でも存在感を発揮しています.酸化チタンはバンドギャップが大きく、紫外光以上のエネルギーを持つ光でしか動作しないのが弱点であり、可視光でも動作する光触媒材料の研究も進められています.
参考文献
Chemistry–A European Journal, 2018, 24.69: 18204-18219.
Advanced Materials, 2019, 31.50: 1901997.
Journal of photochemistry and photobiology C: Photochemistry Reviews, 2012, 13.3: 169-189.
化学と教育 2008 年 56 巻 9 号 p. 436-437
化学と教育 1998 年 46 巻 12 号 p. 772-777
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).