酸化銅(Copper Oxide)
銅といえば、10円玉に代表されるように生活の中でよく見かける金属です.あらゆる金属の中でもトップクラスの電気伝導度と熱伝導度を示しながら安価であるため、導線や金具の材料として欠かせません.鉄に次いで最もよく使用される金属元素といえるでしょう.
鉄とは異なり、銅は錆びにくい金属です.それでも、屋外に出しておけば酸化し、錆(酸化銅)ができることがあります.銅が酸化して形成された酸化銅は、元の銅とは色も性質も全く異なります.中学の理科の実験でよく銅を酸化して酸化銅を作りますが、その酸化銅にどのような用途があるかを考えたことはあるでしょうか.
今回は、酸化銅の種類、性質、用途を見ていきます.
- 酸化銅(Copper Oxide)
- 酸化銅の価数について
- Cu+のみを含む酸化銅 Cu2O
- Cu2+のみを含む酸化銅 CuO
- Cu+とCu2+を両方含む酸化銅 Cu4O3
- 銅の過酸化物 CuO2
- まとめ
- 参考文献
酸化銅の価数について
銅が酸化されると、多くの場合は1価と2価の価数をとります.こうして生成したと
が酸化物イオン(2価の陰イオン)と反応することを考えると、考えうる化合物は
を含む
と
を含む
です.
通常はこれで事足りるのですが、中にはより酸素数の多いや
などの物質が存在しています.
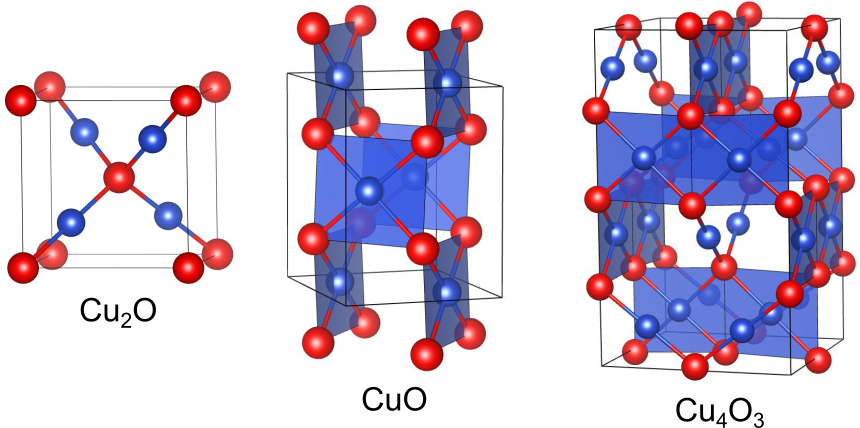
Cu+のみを含む酸化銅 Cu2O
は
のみを含む赤い酸化物で、鉱物名は赤銅鉱として知られます.結晶構造は他ではあまり見られない珍しい構造です.この構造では
が面心立方構造をとり、
がその隙間を埋めるように体心立方構造をとります.結果として、イオンは2つの酸素に両側から挟まれるように配位(直線配位)されています.

の主な用途は、船底にフジツボなどの海生生物が付着しないように塗布する防汚塗料です(だから、大型船の船底はみんな赤いのですね).その赤さを活かし、セラミックの赤色顔料としても使用されます.また、ナノ構造体にすることでガスセンサー、酸化反応の触媒、光触媒、光電流の生成など幅広い活用法があります.
は反磁性で磁性材料としては面白くないですが、半導体材料としては抜群に面白い性質を示します.半導体にはp型とn型の2種類があり、両方を組み合わせて使うことが重要なのですが、ほとんどの酸化物はn型のものしかありません.ところが
は酸化物でありながらp型でかつ良好な導電特性を示すため、太陽電池や光化学デバイス分野で重宝されています.
Cu2+のみを含む酸化銅 CuO
のみを含む酸化が
であり、
とは異なり黒色の物質です.天然鉱物では黒銅鉱として知られます.
の結晶構造もまた独特なものです.それぞれの銅イオンは酸素に四角形状に配位されており、その四角形が頂点を共有することで三次元的なネットワークを形成します.全体としては単斜晶系の対称性を持ちます.

は銅を含む主要な鉱物であり、様々な銅化合物の原料として使用されます.
と同様にp型半導体材料であることを活かした利用法もあり、特に
はバンドギャップが 1.2-1.7 eV と小さい関係で太陽光をよく吸収するため、光触媒材料として活用されます.さらに、
は磁性と強誘電性を併せ持つマルチフェロイック材料としても知られています.
Cu+とCu2+を両方含む酸化銅 Cu4O3
はパラメラコナイトという鉱物の名で知られています.銅の酸化数を求めると
となりますが、これは
と
が1:1の比で含まることを意味します.
の結晶構造は、正方晶系に属し、なかなかややこしい構造をしています.
は
と同じように酸素に直線状に配位され、
は
と同様に四角形状に配位されています.
の結晶構造は、これら2種類のユニットが組み合わさってできたものです.

パラメラコナイト自体が非常に珍しい鉱物であり、安定性も低いため、に関する研究は多くありません.しばらくは貴重な天然鉱物を使うか収量の少ない方法で合成するしかありませんでしたが、基板上に物質を堆積させる薄膜の形では合成がうまくいくことが分かり、合成法の主流となります.
では磁性を示す
がパイロクロア格子を組むため、磁性材料として注目されるほか、触媒特性に関する研究もあります.
銅の過酸化物 CuO2
銅は通常3以上の酸化数をとりません.という組成だけ見ると(
があるように見えますが、実際の価数は
と書けます.ここで、酸素は分子状となり二量体として存在しています.
は不安定で、酸素を放出しながら他の酸化銅へと分解します.
まとめ
銅は身近ですが、銅の酸化物はどうでしょうか.銅は簡単には錆びないこともあって酸化鉄ほど身近ではありませんが、多くの用途で使われる便利な材料です.地球上に豊富にあり無毒であることが最大のメリットであり、既存の材料を置き換えることができれば資源的にも地球環境的にも重要なインパクトがあります.
参考文献
Cu2O
"Cu2O: electrodeposition and characterization." Chemistry of materials 11.12 (1999): 3512-3517.
"Morphologically controlled synthesis of Cu2O nanocrystals and their properties." Nano Today 5.2 (2010): 106-116.
"p-Type and n-type Cu2O semiconductor thin films: Controllable preparation by simple solvothermal method and photoelectrochemical properties." Electrochimica Acta 56.6 (2011): 2735-2739.
CuO
"Engineering nanostructures of CuO-based photocatalysts for water treatment: current progress and future challenges." Arabian Journal of Chemistry 13.11 (2020): 8424-8457.
"Cupric oxide as an induced-multiferroic with high-TC." Nature materials 7.4 (2008): 291-294.
Cu4O3
"Capturing phase evolution during solvothermal synthesis of metastable Cu4O3." Chemistry of Materials 28.9 (2016): 3080-3089.
"Complete oxidation of isopropanol over Cu4O3 (paramelaconite) coating deposited on fiberglass by CVD." Applied Catalysis A: General 356.1 (2009): 36-42.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).