更新 2024-2-23
結晶構造の中の多面体
結晶構造は一見複雑ですが、細かい部分を見ると案外単純な作りをしています.
イオン結合性の物質では、反対符号のイオンが近くに存在したがります.そのため、陽イオンは必ず陰イオンに囲まれ、陰イオンは必ず陽イオンに囲まれています.
一般に陽イオンは陰イオンよりもかなり小さいため、陰イオンを充填させた間隙に陽イオンを配置させたという見方がしっくりきます.陽イオンが陰イオンに囲まれた多面体を見つけることができれば、後はそれがどのように連結しているかを調べることで結晶構造が理解できます.
例えば塩化ナトリウム()型構造では、
は6つの
に八面体形に配位されています.この八面体が互いの稜(辺)を共有することによって構造が出来上がります.一方、ウルツ鉱(
)型構造では、
は4つの
に四面体形に配位されています.この構造では四面体が互いに頂点を共有しています.
このように、結晶構造の多くは多面体とその連結(ネットワーク)によって完成します.今回は、こうした多面体によって結晶構造がどのように形成されていくかを見ていきます.
様々な多面体
一般に、陽イオンのサイズが大きくなるほど配位数は増加します.陽イオンが大きくなると、その周りを覆うために必要な陰イオンが増えるためです.
陽イオンのサイズはその価数によって決まりますが、価数が大きいほどサイズが小さくなります.これは正電荷が増えることで、周りの電子がより強く引き付けられるためです.
一方、陰イオンは価数が大きいほどサイズが大きくなります.これは陽イオンの場合とは逆に、負電荷が大きくなるほど電子1つあたりを引き付ける力が弱くなるためです.大きなイオンは互いに反発し合うため、陰イオンが大きくなると配位数は減少する傾向があります.
配位数は陰イオンと陽イオンのイオン結合半径の比の値を用いることで整理でき、これをポーリングの第一法則と呼びます.
多面体の例
よく見られる配位数は二配位から八配位程度までですが、それ以上の配位数も存在します.一方、配位数だけでは「配位の形」(配位構造)までは決まりません.
例えば6配位であれば、八面体配位の場合も三角柱型の配位構造もありえます.どちらの配位をとるかは中心カチオンの電子状態や大きさなど様々な要因で決まります.
まず、それぞれの配位数についてどのような形の配位が見られるかを見ていきます.
それぞれの配位数について、代表的な配位構造をまとめました.
(配位数=Coordination number = CN)
(二配位)
カチオンに二配位するためには直線状に配位するしかありません.結合方向以外が覆われていない(スカスカ)なので安定性が低そうで、あまり見かけない配位です.
銀や銅などd10の電子配置をとる金属イオンが二配位をとることが知られています.
(三配位)
三配位も三角形状の配位しか選択肢がありません.こちらも上下が覆われていないので不安定で、固体ではほとんど見かけることがありません.
一部の錯体においてよく知られています.

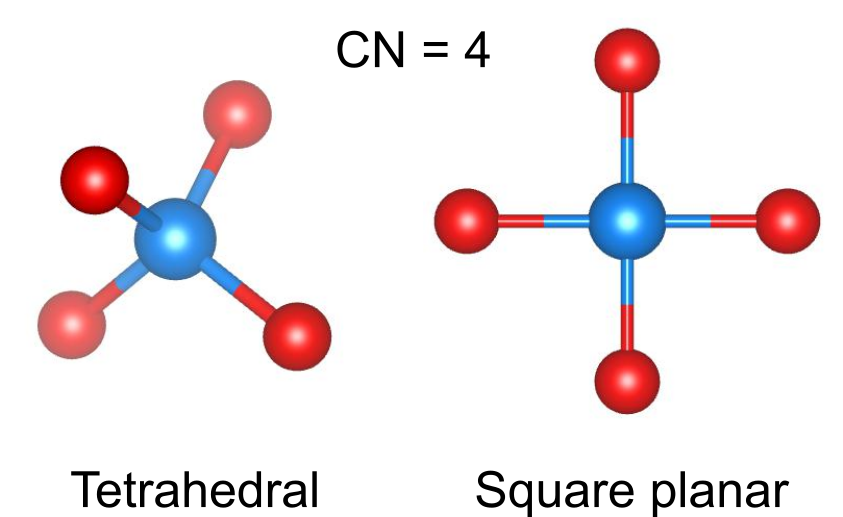
(四配位)
四面体配位と正方形配位の二種類の配位構造が考えられます.
四面体配位は、六配位の八面体構造と並んで最もメジャーな配位構造の一つです.スピネル型、ウルツ鉱型、閃亜鉛型など多くの結晶構造において見られます.
3d金属(第四周期)の金属の酸化物の多くは八面体をとりますが、周期表の右に行くほど、また高価数になるほど四面体配位をとる傾向にあります.セレンやアンチモンといった大きめのアニオンでは多くが四面体配位をとります.
正方形配位は上下にアニオンが覆われないので不安定であり、正方形配位は特殊な電子状態の金属イオンにおいてのみ見られます.
例えば、d8の電子配置を持つ金属イオンは正四面体配位を好むことが知られています.また、d9のや
はヤーン・テラー効果によって正方形配位が安定になりやすいです(
).
例外として、d6のでも正四面体配位を持つ物質が存在します(
).d7の
でもありました(
).
(五配位)
五配位は中途半端なのか、四配位と六配位の方をよくみかけます.五配位にはピラミッド型(四角錐型)と三方両錐型の2パターンがあります.
四角錐型の報告は多くはないですが、を含む
や
を含む銅酸化物高温超伝導体で見られます.
三方両錐型も、や
など一部の酸化物で報告があります.

(六配位)
最もメジャーな八面体配位に加え、三角柱型の配位構造が知られています.
八面体配位は非常に多くの酸化物で見かけます.八面体の含まれていない酸化物のほうがレアなのではないかと思います.ペロブスカイト型、塩化ナトリウム型、スピネル型、ルチル型など思いつく多くの構造は八面体配位を含んでいます.
三角柱型はどちらかと言えば報告数は少ないですが、遷移金属ジカルコゲナイド(TMD)や電池材料(など)において見かけることが多い気がします.

(七配位、八配位)
この辺りまで配位数が増えると大抵はキレイな多面体ではなく、表現し難い歪んだ配位構造を持っていることが多いです.(そもそも七配位では正多面体を作れないという話は置いておいて)
八配位では正方形型の配位が知られており、フッ化カルシウム型構造などで見られます.
多面体の連結
多面体を考えるだけでは錯体にしかなりません(錯体に失礼).
固体中では多面体同士が連結することによってネットワークを形成し、結晶構造が成り立ちます.どの多面体も連結することが可能ですが、ここでは八面体を例に取ります.
八面体の連結方法は大きく3種類に分けられます.
・頂点共有(Corner share)
・稜共有(Edge share)
・面共有(Face share)
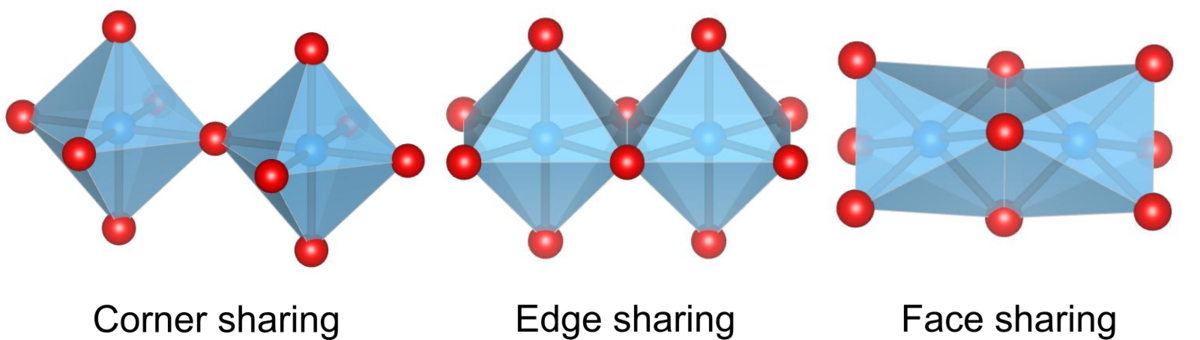
まず、八面体の頂点を共有する形式があります.ペロブスカイト型を代表として普遍的に見られる連結方法です.稜(辺)を共有する構造は、ルチル型や塩化ナトリウム型などの構造で見られます.面共有はあまり見かけないですが、それでも型などの物質で見られます.
多面体の連結と安定性
さて、物質にとってはどの配位構造を持つのが安定でしょうか.
イオン結晶では、同符号のイオンをできるだけ離してクーロン反発を抑えたいという考えがあります.
点共有ではカチオンとカチオンの間にアニオンがあるので問題ないですが、稜共有、面共有になるに連れてカチオンーカチオン距離が短くなって不安定になります.面共有を持つ酸化物は頂点共有と稜共有を持つ酸化物よりも顕著に少ないことが知られています.
実際、「配位多面体における稜の共有、また特に面の共有は構造の安定性を低下させる」という経験則が知られており、ポーリングの第三法則と呼ばれます.
実際の物質では以上の連結様式を様々な比で組み合わせることで構造が成り立っています.頂点共有・稜共有・面共有が全て組み合わさった結晶構造も多くあります.
頂点共有と稜共有に関しては2つの多面体がある程度回転することができ、柔軟に角度を変えられる一方、面共有ではこのような自由度はなく、2つの多面体は固定されています.
まとめ
どんな複雑な結晶構造でも、一つ一つのパーツを見ればシンプルな形をしていることが多いです.後は、多面体とその連結を考えれば、どんな結晶構造も理解できる(はず)です.
今回の話はイオン結晶については全て当てはまりますが、共有結合結晶や金属ではもっと複雑で解釈の難しい構造も出てきます.しかし、基本の考え方はイオン結晶と同じようにできているので、なんとかなるはずです.
結晶構造の見方は、今回のように多面体と連結から考える方法と、最密充填から考える方法があります.前者はセラミックス関連の人が、後者は金属材料を扱っている人や物理の人によく見られるように思います.
考え方は人それぞれですが、物質の構造はひとつなので方法に気を取られる必要はないはずです.
参考文献
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).