更新 2024-3-3
イオンと価数
化学の授業では、各元素ごとに安定な価数があることを教わります.例えば、周期表1族であるアルカリ金属は1価の陽イオンになりやすく、逆に17族のハロゲン元素は1価の陰イオンになりやすいとされます.貴ガスの電子配置は極めて安定であり、アルカリ金属やハロゲン元素は貴ガスの電子配置を目指して電子を手放したり受け取ったりします.
周期表の左側にあるアルカリ金属やアルカリ金属などの典型元素はイオン化エネルギーが低く、電子を手放すことで陽イオンとなり、貴ガスの電子配置になります.一方、周期表右端のハロゲンなどは電子親和力が大きいために、電子を受け取って陰イオンとなり、こちらも貴ガスの電子配置が生成します.

一方、遷移金属の価数の取り方はやや変則的です.一般にあらゆる遷移金属は陽イオンになりやすいですが、どの価数が安定であるかは元素によって異なります.周期表の下に行くほど高価数を取りやすいなどの一般則はありますが、遷移金属がどの価数をとるかについての簡便な規則はありません.いずれにせよ、陰イオンとなることは通常ありえません.
周期表に元素は数あれど、価数に関する一般的な規則は以上の通りであり、これらの規則に反する物質はなかなか見つかりません.しかし、ルールは破るためにあると言われるように、何事にも例外があります.
ある種の物質中では金属が陰イオンとして振る舞います.また別の物質では、貴ガスの陽イオンや陰イオンが存在します.今回は、教科書には書かれていない、不思議な価数を持つイオンについて紹介します.
- イオンと価数
- 水素の陽イオンと陰イオン
- アルカリ金属の陰イオン
- 異常高原子価陽イオン
- 金属の陰イオン
- 貴ガスの陽イオン
- 貴ガスの陰イオン
- 高価数のアルカリ金属陰イオンとハロゲン陰イオン
- まとめ
- 参考文献
水素の陽イオンと陰イオン
水素は、宇宙で最もありふれた元素です.しかしながら周期表の中ではむしろ特殊な元素であり、他の元素とは大きく異なる特徴を持ちます.
水素原子は、一つの陽子と一つの電子から構成されます.この一つの電子が価電子に相当し、内殻電子を持ちません.まず、水素には価電子が一つしか無いので陽イオンになりえます.陽イオンになった水素は陽子そのもので、水素の陽イオンをヒドロン(陽子、プロトン)と呼びます.
ここまでは他の1族元素であるアルカリ金属と同じですが、水素が一線を画するのはここからです.水素の最外殻軌道に一つだけ電子を加えると貴ガスであるヘリウムと同じ電子配置になります.このため、電子を一つ加えることにも寛容で、水素は陰イオン(ヒドリド)にもなることができます.

すなわち、水素は正と負の両方の価数を持つことの出来る稀有な元素です.水素陽イオンは一般的で、水の中や酸性物質の中をはじめとしたあらゆる環境で見られます.水素陰イオンはやや珍しいですが、それでも電気陰性度の小さな金属元素と化合物を作る際に見られます.
中には、一つの物質中で水素陽イオンと水素陰イオンが共存するような物質も存在します.
アルカリ金属の陰イオン
1族元素の中で、水素だけが陰イオンになり得る話をしたばかりですが、他の1族元素(アルカリ金属)は陰イオンにはならないのでしょうか.いずれも非常にイオン化エネルギーが小さく、簡単には陰イオンにならなさそうです.しかし、舞台を整えてあげればやはりアルカリ金属も陰イオンとなるのです.
残念ながら、固体の状態でアルカリ金属陰イオンを実現することは困難で、多くの場合は分子の力を借りる必要があります.アダマンザンやクリプタンドの中にアルカリ金属を閉じ込めたものが有名であり、物質によってはアルカリ金属の陽イオンと陰イオンが共存します.
アルカリ金属の陰イオンはアルカリドと総称されます.アルカリ金属はs軌道に電子が一つだけ詰まった電子配置であり、ここに一つの電子を追加することでs軌道が完全に満たされるので、ある程度の安定性が得られるのではないかと推測します.
異常高原子価陽イオン
例えば酸化物中の鉄は通常、2価か3価の価数をとります.4価や5価の鉄は不安定で、強い酸化状態などの特殊な条件でのみ見られます.同様に、ニッケルの4価や銅の3価なども特殊な価数です.
このように、通常では見られないような高価数のイオンを指して異常高原子価陽イオンと呼びます.や
などの物質が知られます.
鉄の4価を例に取ると、鉄から4つの電子が奪われた状態と考えられますが、実際にはそうではありません.鉄から電子を3つ奪う()と、
の電子軌道よりも酸素の電子軌道のほうがエネルギー的に上に来てしまい、これ以降の電子は鉄ではなく酸素から抜き取られることになります.
酸素から電子が奪われることで酸素の電子軌道には正孔(ホール)が残された状態となります.この正孔をリガンドホールと呼び、ホールの局在・移動に伴って特殊な電子相転移を起こすことがあります.例えば、逐次相転移や電荷不均化などの珍しい現象が見られるほか、超伝導の形成などが予想されています.
金属の陰イオン
遷移金属は陰イオンにならないという話をしましたが、必ずしもそうとは限りません.原子が電子を受け入れると陰イオンとなるわけですが、各々の原子について電子の引き付けやすさの指標を電気陰性度と呼びます.電気陰性度の大きい元素ほど陰イオンになりやすいと言い換えることができます.
予想通り、ハロゲン(17族)やカルコゲン(16族)元素の電気陰性度は高く、特にフッ素や酸素が大きな値を持ちます.一方、アルカリ金属やアルカリ土類金属は小さな値を持ちます.
しかし、中には遷移金属にも関わらず大きな電気陰性度の値を持つものがあります.特に目を引くのが、金や白金などの第6周期金属です.金や白金と言えば錆びにくく反応性が低いイメージがありますが、電子を受け入れることはあるのでしょうか.
実際のところ、金や白金は電子を受け入れて陰イオンとなることができ、電気陰性度の小さいアルカリ金属との化合物であるや
などの物質が知られています.
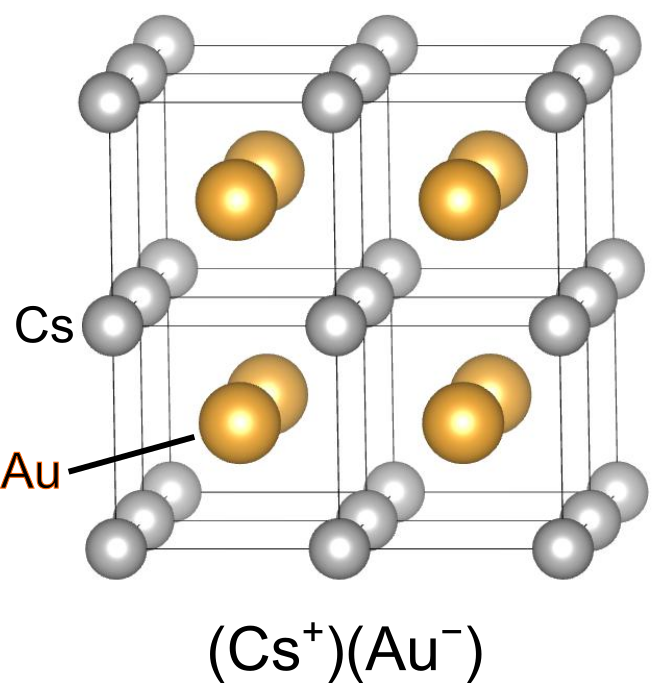
に電子を一つ加えるとd軌道が閉殻となるため、ある程度の安定性が生じるものと考えられます.また、電子の相対論的効果の影響も大きいものとされます.
また、ビスマスや鉛などの元素も通常は陽イオンとして認識されていますが、特定の物質では陰イオンとして振る舞います.、
、
などの物質が知られています.
貴ガスの陽イオン
貴ガスでは、原子軌道の最外殻軌道が閉殻となっているため、化学的に非常に安定です.多くの元素が貴ガスの電子配置を求めてイオンを形成することを考えれば、その安定性もうなずけます.その貴ガスがイオンとなるのであれば、考えの根本が歪んでしまいそうな気がします.
しかし、低周期数のや
でこそ絶大な安定性を誇るものの、高周期数の
や
では雲行きが怪しくなってきます.最外殻の電子が核とあまりに離れてしまい、電子を束縛する力が弱まっているのです.このため、条件を整えれば
などの貴ガス元素から電子を奪うことができそうです.

などの貴ガス元素から電子を奪う事が可能なことはLinus Paulingが1930年頃に予測していました.そして実際に、1960年代には
の化合物である
、
、
などが合成されました.
それ以来、何百もの貴ガス化合物が知られており、今日では貴ガス化合物は珍しいものではなくなっています.
貴ガスの陰イオン
前節で紹介した希ガス化合物は、いずれも貴ガスが陽イオンとして振る舞うものです.では、貴ガスは陰イオンにはならないのでしょうか.価電子を取り去るのではなく、新しい最外殻軌道に電子を入れる?
想像の付かない事態ではありますが、それを実現する手段があります.「高圧」です.
高圧と言っても手で押すレベルの圧力ではありません.数百GPという地球の内殻レベルの高圧をかけることで、閉殻の最外殻軌道の上から電子を押し込むことが可能になります.これにより、例え貴ガスであっても陰イオンとすることができるのです.
貴ガスの陰イオンは当初は理論的に予測されたものであり、と
、
と
、
と
などの化合物の存在が理論計算から示唆されました.これらの物質を実験的に合成することは困難な課題でしたが、
と
からなる二元系物質が報告されるなど、実験的にも進展の著しい分野です.
高価数のアルカリ金属陰イオンとハロゲン陰イオン
アルカリ金属が陰イオンとなりうることは紹介しましたが、その場合でも取りうる価数は-1が限度でした.一方、超高圧の世界ではさらに高価数の陰イオンとなりうることが予測されています.
例えば、の二元系物質を超高圧で形成すると、
から
に電荷移動が起こるとされ、-1価を超える
陰イオンが生じるとされています.
また、同様に超高圧下ではハロゲンが-1価を超える価数を持ちうると予測されています.例えば、系や
系でハロゲンが-4価や-5価などの価数をとるという計算結果があります.さらに、貴ガスが-3価などの価数をとりうるという主張もあります.
もう何でもありですね.
まとめ
元素によってとりうる価数は異なり、大多数の化合物中では元素の価数は特定の値になります.しかし、特殊な状況を作り出せば元素の特性も大きく変わります.環境を整えれば、アルカリ金属だって陰イオンになるし、貴ガスだってイオンを形成するのです.
超高圧下では状況はもっと極端であり、常圧に生きる我々には想像もつかないような事態が起こります.とはいえ、1 atm程度の地球上に住む我々だからそう思うのであって、圧力の異なる環境にいる者にとっては当たり前のことなのかもしれません.超高圧下で生きているような宇宙人がいれば、貴ガスの反応性が乏しい地球上の環境に驚くことでしょう.
参考文献
Nature Reviews Chemistry, 2020, 4.10: 508-527.
Communications Chemistry, 2022, 5.1: 1-4.
Scientific reports, 2015, 5.1: 1-8.
EPL (Europhysics Letters), 2017, 117.2: 26002.
Nature Chemistry, 2017, 9.5: 440-445.
Nat. Commun. 5, 4861 (2014).
Science, 2013, 342.6165: 1502-1505.
Inorganic Chemistry, 2016, 55.18: 9377-9382.
The Journal of Physical Chemistry C, 2016, 120.36: 20033-20039.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).