更新 2024-2-23
ケテラーの三角形(Van Arkel–Ketelaar triangle)
電気陰性度とは「原子が電子を引き付ける強さの指標」のことでした.
元素の電気陰性度が分かると、ある二種類の元素からなる化合物中でどのような結合を形成するか予想できるようになります.ある2つの元素が化合物を作る場合、電気陰性度の差が大きい(例:)場合はイオン結合を、電気陰性度の差が小さい場合(例:
)は共有結合を形成するのでした.
電気陰性度の大きな元素がより電子を引き付け、電気陰性度の差が極端に大きければ全ての電子を奪ってアニオンになります.しかし、実際の物質はこれほど単純ではなく、多くがイオン結合と共有結合の間の状態をとります.
さて、どのように折り合いをつけるのでしょうか.
電気陰性度を用いて、結合のイオン結合性や共有結合性を視覚的に導出することが可能なのがケテラーの三角形です.
ケテラーの三角形を見てみよう
ある二種類の元素の組み合わせを考え、横軸に両者の電気陰性度の平均(χmean)、縦軸に両者の電気陰性度の差の絶対値(Δχ)をとります.こうすることで、各頂点にイオン結合、共有結合、金属結合が当てはめられます.

すなわち,「電気陰性度の差が大きい」ものはイオン結合,「平均の電気陰性度の値が大きく、かつ電気陰性度の差が小さい」ものは共有結合,「平均の電気陰性度の値が小さく、かつ電気陰性度の差が小さいもの」は金属結合となります.
全ての化合物は電気陰性度の値がこの三角形の中にあり、物質によってどの結合性が強いか(弱いか)を視覚的に表した点が画期的です.
電気陰性度の最も小さな元素と電気陰性度の最も大きな元素
は三角形の底辺の両端に位置します.三角形の頂点に位置する物質は[tex:\rm{Cs、CsF、F_2}]です.それぞれ金属結合性、イオン結合性、共有結合性が最も大きい物質とされます.
三角形の内部にある物質は、三角形のどこに位置しているかによって、どの結合性がどの程度配分されているか一目でわかります.
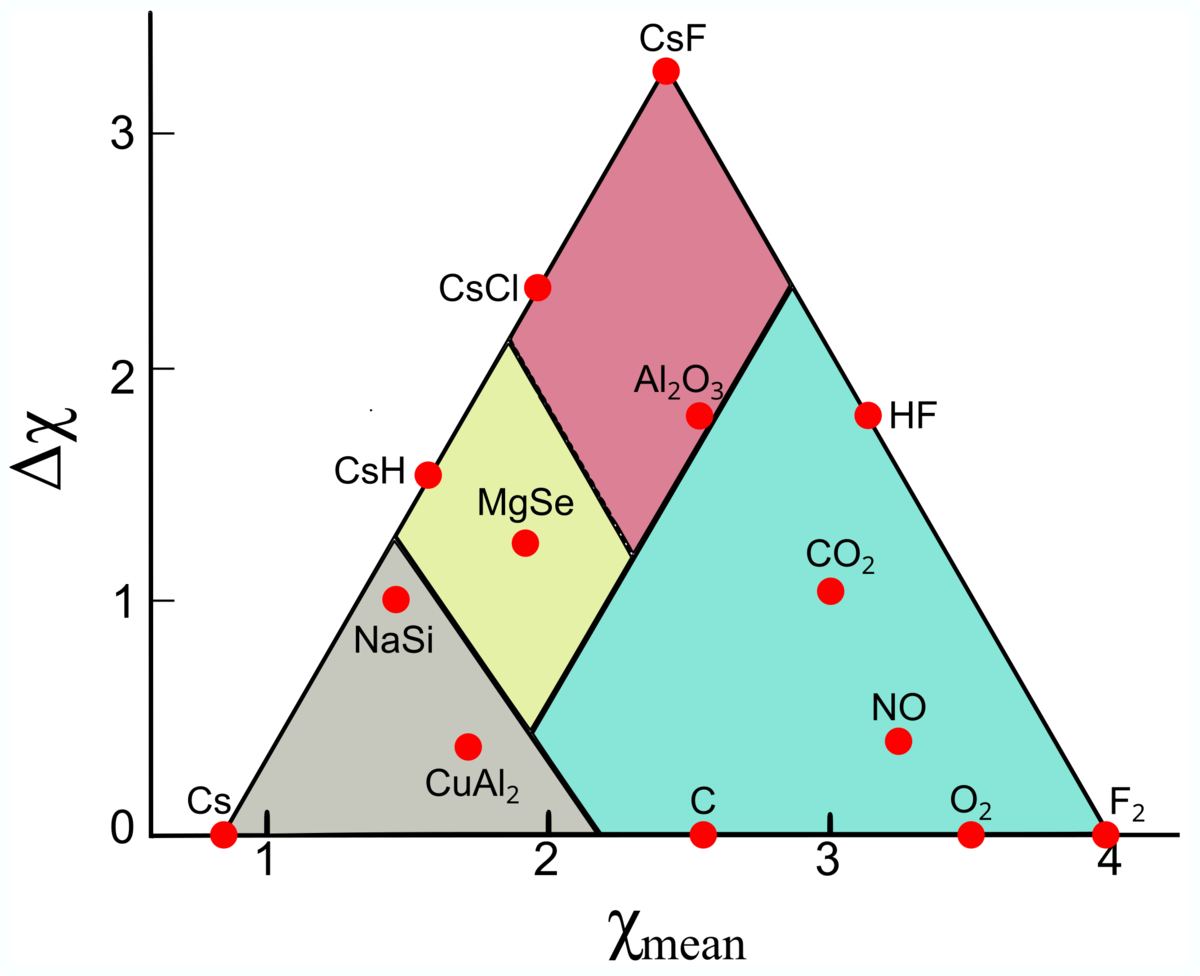
イオン結合性、共有結合性は電気陰性度の話のときに出てきましたが、ケテラーの三角形には第三の結合様式として金属結合が存在しています.金属結合は電気陰性度を用いてどのように理解すればよいでしょうか.
「平均の電気陰性度の値が小さく」かつ「電気陰性度の差が小さい」状態は、周期表を見れば分かる通り多くの金属元素が該当しています.
電気陰性度が小さいということは、原子から電子ができる限り離れたいわけであり、金属原子がゆるく複数の電子を共有する金属結合が生成します.一方、平均の電気陰性度の値が大きければ電子は原子の近くにいたいので、ある程度の局在性を持った共有結合が形成されることになります.
おや、ケテラーの三角形でイオン結合と金属結合の間に見慣れない領域が存在していますね.これらはジントル相(Zintl相)と呼ばれる物質群です.半導体的な電気伝導率、セラミックのような脆さを持ちながらも金属光沢を示す不思議な物質です.日常材料で見かける機会はなかなかないですが、学術的に面白い性質を示します.
ケテラーの三角形の成立
この概念は1941年にA. E. van Arkelによってもたらされました.当時は36種類の物質を三角形の内部に配置し、化合物によって結合の種類が異なることを示しました.その後、J. A. A. Ketelaarは、三角形の辺にさらに多くの化合物を配置し、このアイデアを発展させました.
あれ、アイデアの端緒はvan Arkelなのに日本ではKetelaarの名前でのみ知られています… ご心配なく、他の言語圏ではきちんとvan Arkel – Ketelaarの三角形と呼ばれています.(日本語に訳すときvan Arkelの名前を削った人は誰でしょう.)
日本語訳に従って本記事中では「ケテラーの三角形」で統一することにしました.
その後、多くの人が電気陰性度以外のパラメータも利用して三角形を作成しましたが、現在ではケテラーの三角形のみが生き残っています.教科書でよく見られる三角形もケテラーが作成したものです.
まとめ
今日では教科書でみかけるだけで、実務で用いられることは少ないイメージのケテラーの三角形ですが、改めて眺めてみると意外な発見があるかもしれません.
参考文献
Journal of molecular structure, 1993, 300: 647-655.