更新 2024-2-23
イオン化傾向(Ionization tendency)
鉄は錆びやすいのに、金は全く錆びません.
「錆びる」とは酸化反応の一種で、「錆びやすい」は「酸化されやすい」と言い換えることができます.酸化のされやすさは元素によって大きな違いがあり、リチウムをはじめとしたアルカリ金属は空気中で迅速に酸化されるのに対し、金や白金をはじめとした貴金属は日常生活では酸化されることがほとんどありません.
このような「酸化のされやすさ」を定量化する方法はないでしょうか.高校化学では「イオン化傾向」の概念を習いました.イオン化傾向とは、金属が陽イオンになりたがる(酸化されたがる)傾向の順番を表したものです.習った年代によってどのような化学種が登場するか異なると思いますが、おおむね以下のような順でしょうか.*1
何らかの語呂合わせで記憶させられた人も多いかと思います.しかし、改めて考えると不思議な概念です.どうやって求めたのでしょうか.また、いつでも成り立つ式なのでしょうか. 溶液は?温度は?濃度は関係ない?
今回はイオン化傾向の正体に迫っていきます.
標準電極電位(Standard electrode potential)による定量化
先に結論を言ってしまいますと、イオン化傾向は、金属の「標準電極電位」の値を並べたものです.知らない単語が出てきたからといって逃げ出さないでください.まずは以下のような半反応を考えてみます.ナトリウムイオンの還元反応です.
(1)
ナトリウムは酸化されやすい(還元されにくい)ので、上式は右側には進みにくいことが予想されます.実際、上式は自発的には進行しないことが分かっています.
一方、次の式ではどうでしょう.
(2)
金は酸化されにくい(還元されやすい)ので、上式は迅速に反応して単体の金が生成することが予想されます.
このように、反応によって進行しやすさに大きな違いがあります.この「反応のしやすさ」はギブズエネルギー変化という熱力学的な量を考えることで定量化できます.ギブズエネルギー変化は、ここではエネルギー変化程度の意味に捉えてください.
(ギブズエネルギーはエントロピーを考慮した高級な概念ですが、電気化学反応を行う常温ではほとんど問題にならず、エネルギー変化だけを考えれば事足ります.)
反応のギブズエネルギー変化が負であれば、反応は自発的に進む.
以上のように、金属イオンと電子の反応を考えてエネルギー変化を比べれば、金属の酸化されやすさ(還元されやすさ)の指標になると考えられます.ただし、温度や濃度などによって値が変わってしまうかもしれないので、条件は可能な限り揃えます.
このままギブズエネルギー変化を「酸化しやすさ」の指標に用いても良いですが、電気反応に用いることを考えれば、エネルギーを電位で表したほうが使い勝手が良いです.電池のパワーが1Vと言われたらなんとなく分かりますが、1.602176634×10−19 Jと言われてもピンときません.
エネルギー変化を電位差に変換するにはファラデー定数(F)を用います.
なお、nは反応にかかわる電子数、Fはファラデー定数(96485 C mol−1)、Eは電位です.マイナスの符号は電子が負電荷を持っていることに由来します.
こうして求めた電位を、標準電極電位と呼びます.電位には基準が必須なので、水素陽イオンの還元反応の電位をゼロと定義しています.
(3)
電子は負の電荷を持っているので、電位が正に大きい方が安定で、負に大きい方が不安定です.
標準電極電位が負に大きい=酸化されやすい.
金属の標準電極電位
イオン化傾向に現れる元素の標準電極電位を並べてみましょう、
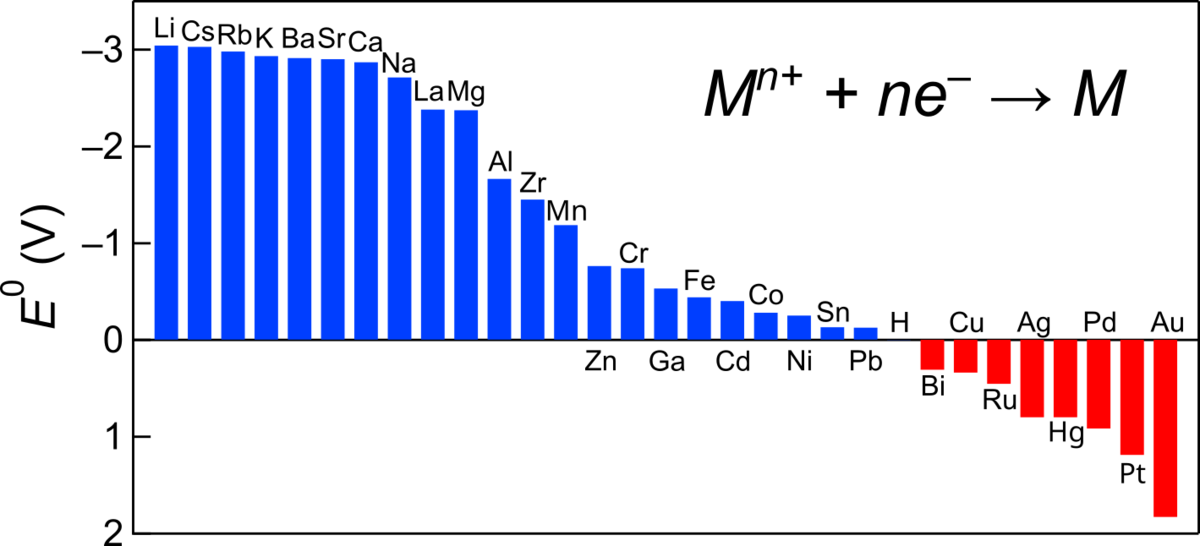
学校で習ったイオン化傾向の順番と標準電極電位の順が一致していることが分かると思います.とはいえ、合致するのは定性的な傾向だけで、定量的にはイメージとのギャップがあります.
イオン化傾向で不等号で結ばれる元素であっても、標準電極電位で見るとほとんど差がないことが分かります.
例えば、と
はほぼ同じ値でこの程度の値の差では試料調製の条件の違いで容易に逆転してしまいます.また、
と
の差はもっと僅かで、不等号をつける意味があるのかも疑わしいほどです.
と
をつないで電池を作っても意味のある結果が生まれることはないでしょう.
陰イオンの標準電極電位
また、当然ながら標準電極電位は金属以外の元素についても定義することができます.塩素やフッ素といった元素は陰イオンになりやすい(還元されやすい)ですが、そういった傾向も定量的に表すことができます.
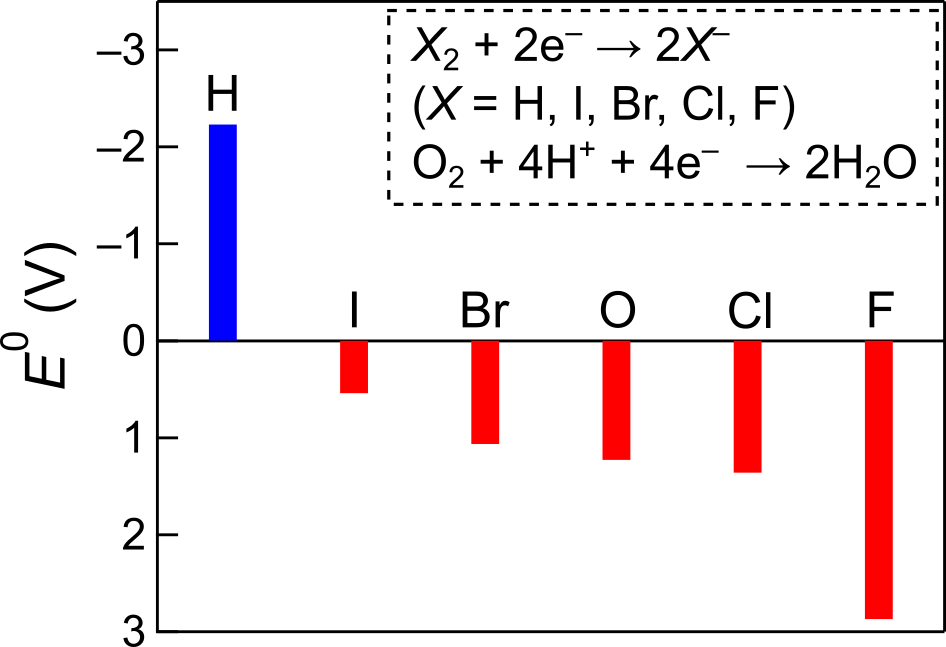
例えば、ハロゲンでは >
>
>
という順番で還元されやすい(陰イオンになりやすい)ことが分かります.他には、塩素の方が酸素よりも還元されやすいことも分かりました.すなわち、塩素イオンのほうが酸素イオンよりも生じやすいはずです.
あれ、高校で習った塩化ナトリウム水溶液の電気分解反応では「塩素の方が酸素よりも酸化されやすいから食塩水の電気分解では陽極で塩素分子が発生する」と習ったような…
このように不都合があることが、高校で陰イオンのイオン化傾向を習わない理由かもしれません.電気化学反応はイオン化傾向や標準電極電位の値だけで決まるほど単純ではないということです.
標準電極電位の実際
実際の溶液では、標準電極電位で定義された反応式と同じ反応を起こしても、表にある電位とは異なる値を示します.標準電極電位は理想的な極限でのみ成り立つ値であり、実際に電位を測定する際は、温度や濃度の影響を考慮に入れる必要があります.
理想的な標準電極電位と実際の電位は以下のようなネルンストの式で結び付けられます.
なお、E0は標準電極電位、Rは気体定数、Tは温度、zは移動電子数、aは還元側および酸化側の活量を示します.
ここまでしても実際の電位とは異なる値を示すことが多く、現実の材料の複雑さが伺えます.界面、反応速度など他にも様々なパラメータを考慮しなければ現実世界を再現することはできません.
それでも、イオン化傾向と標準電極電位は反応性を予測するための極めて優れた指標であり、電気化学反応を考慮する上では欠かせない情報となっています.
参考文献
化 学 と 教 育 44巻 9 号(1996年)
Standard electrode potential (data page) - Wikipedia
Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
*1:全部書くと長いので標準的なリストからいくつか金属を省いていますが、特に意味はないです.受験生の方は教科書にある標準的なリストを覚えてください.