化学結合(Chemical bond)
手で触れて感じられるほどの大きさの物質には、おおよそ1023個の原子が含まれています.これほど多くの原子が一つにまとまっていられるのは、おそらく原子同士に何らかの引力が働いているからでしょう.
しかし、原子一つひとつは中性であり、引き付け合う力が働くようには思えません.また、原子の外側にある電子は大きな負の電荷を持っているため、原子同士はむしろクーロン力によって反発してしまうのではないでしょうか.しかし、現実に物質は存在しますし、原子同士はつながっています.
このように、原子と原子がつながることは自明ではありません.原子同士に働く引力による原子間のつながりを説明するためにいくつかのメカニズムが提唱・実証されており、それらは化学結合と総称されます.
化学結合はメカニズムの違いによって細分化され、代表的な化学結合として以下のようなものがあります.
- イオン結合
- 共有結合
- 金属結合
- 分子間力(ファンデルワールス力、水素結合)
今回は、これらの化学結合の起源とメカニズム、代表的な物質について見ていきます.
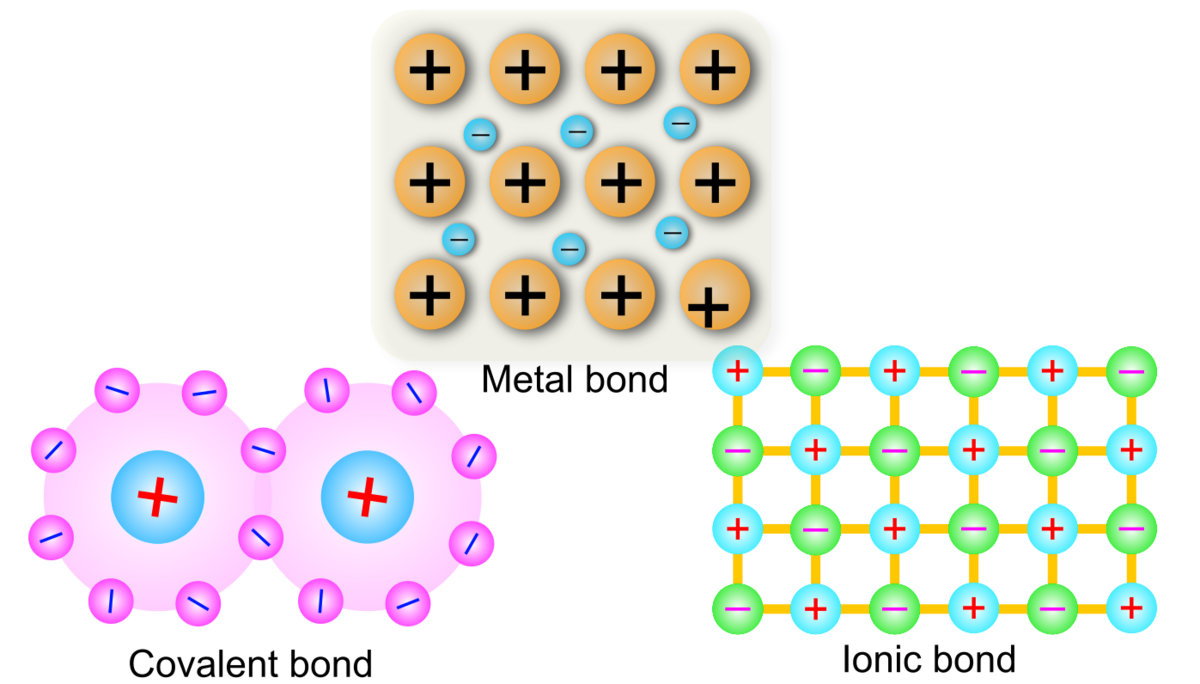
1. イオン結合(Ionic bond)
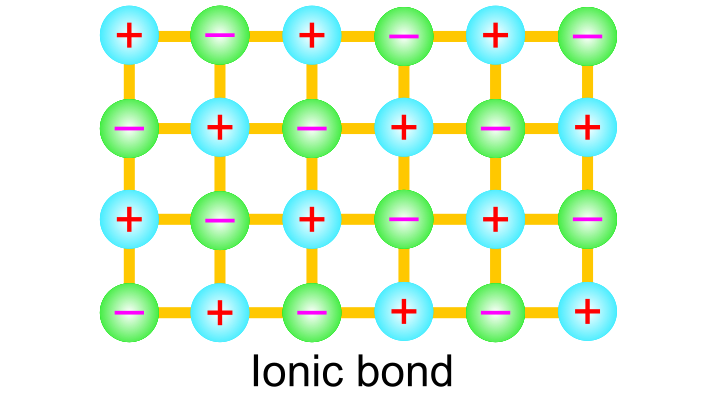
イオン結合は、プラスとマイナスに帯電したイオン間に働くクーロン力によって生じる化学結合です.
原子はそのままでは中性ですが、電子を一つ手放す、あるいは受け取ることによってより安定なイオン(カチオンおよびアニオン)となることが知られています.イオンはプラスまたはマイナスの電荷を持つため、その間には強いクーロン力が働きます.
固体の中でイオンを形成するには、物質中に含まれる原子の一方からもう一方へと電子が移動する必要があります.電気陰性度の大きな原子は電子を引き付けやすく、電気陰性度の小さな原子から電子を奪い取ることで前者がアニオン、後者がカチオンとなってイオン結合を生成します.
塩化ナトリウム()はイオン結合性を示す代表的な物質です.他にもイオン結合性の物質として
や
などがあります.いずれにも電気陰性度の大きい元素(ハロゲン、酸素など)と小さい元素(アルカリ金属、アルカリ土類金属など)が含まれています.
イオン結合性の固体をイオン結晶と呼びますが、これらの結晶構造には特徴があります.イオン結合は異符号のイオンでは引き付け合いますが同符号では反発するため、なるべく異符号のイオン同士が隣り合うように整列します.
例えば、塩化ナトリウム型構造ではと
が決して隣り合わず、
が
を(あるいは
が
を)囲むように並んでいます.
イオン結晶の結晶構造には他にもいくつか経験則が知られており、ポーリングの原理にまとめられています.
イオン結合は非常に強く、イオン結合性の物質であるセラミックなどは優れた強度を示します.融点も高い物質が多いです.イオン結晶の安定性を評価するパラメータとして格子エネルギーがあります.
イオン結晶中で電子はアニオンの周りに引き付けられているので移動できず、それゆえイオン結晶の多くは絶縁体です.一方で、溶液中ではイオン自体が移動することで伝導性を示します.中には、固体であるにも関わらず高いイオン伝導度を示すような物質も知られています.
2. 共有結合(Covalent bond)
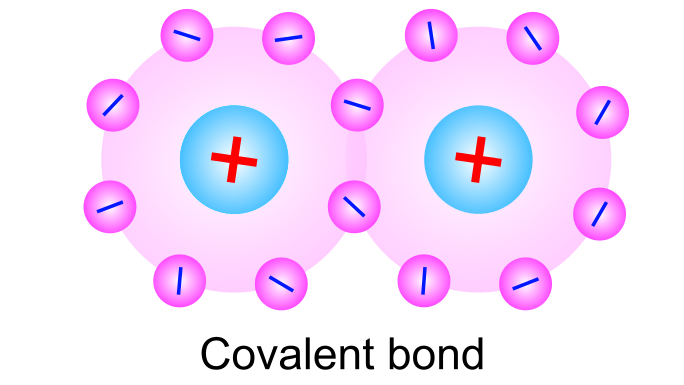
共有結合は、原子間で電子を共有することで形成する化学結合です.
典型的な例では、結合に寄与する2つの原子がそれぞれ電子を一つずつ出し合って共有電子対を作り、原子の間で共有します.多くの分子では電子の共有によって、各原子の価電子がオクテット則を満たすような電子配置をとります.
共有結合は、有機分子では非常に一般的な結合です.有機物で見られる結合はすべて共有結合によってつながっています.電子を2つずつ共有した二重結合、3つずつ共有した三重結合なども見られます.
一方、固体中でも共有結合は見られます.結晶全体に広がる共有結合ネットワークを持つ固体をNetwork solid (ネットワーク固体、ネットワーク共有結合固体、共有結合結晶)と呼びます.
Network solidの代表例はダイヤモンドや黒鉛などの炭素系材料です.ダイヤモンドでは各炭素原子が4本の結合を形成していますし、黒鉛では3本の結合の手を持っています.石英()も代表的なNetwork solidです.珍しいところでは、
などのZintl化合物も結晶全体に広がる原子ネットワークを持ちます.
共有結合は非常に強い結合であることが知られています.実際、共有結合のみで構成されたダイヤモンドは最高級の高度を示します.一方、黒鉛の強度は弱いですが、これは炭素の層間が弱い分子間力で繋がっていることに由来します.
結合の強さに関連して、多くのNetwork solidは非常に高い融点を持ちます.溶媒に溶かすことも困難である事が多いです.
また、共有結合に寄与する電子は2つの原子の間に局在しており、共有結合は非常に方向性が高いです.すなわち、共有結合は等方的ではなく特定の方向を向いています.立体的な制約から、共有結合性を示す分子の形はある程度決まったものとなります.
電子が局在しているということは、電子が流れにくいということです.実際、ダイヤモンドを筆頭に、Network solidの多くは電子の流れない絶縁体です.
3. 金属結合(Metal bond)
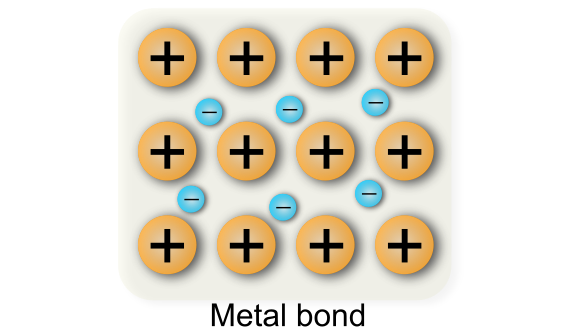
金属結合は、たくさんの正電荷を持つイオンの間で電子が共有されることで形成される化学結合です.共有結合と比べると、共有される電子の密度が非常に小さいことが特徴です.ここで共有される電子を自由電子と呼び、金属に見られる種々の特性の原因となります.
金属結合はその名の通り金属で見られます.金属結合を持つ物質を金属と呼んでしまった方が良いかもしれません.鉄やアルミニウムなど周期表で見られる金属元素から各種合金、金属間化合物でも金属結合が見られます.
金属結合は等方的な結合であり、決まった方向性をもちません.それゆえ、少し原子位置をずらしたとしても問題なく結合を形成します.これにより金属で見られる延性や展性を説明できます.
また、自由に動き回ることのできる自由電子を持つため、金属は高い電子伝導性を持ちます.高温では電子の運動が阻害されるため電気伝導性は低下します.また、電子が熱を運ぶため高い熱伝導性も併せ持ちます.
分子間力
イオン結合、共有結合、金属結合とは異なる化学結合で固体が形成される場合があり、その起源は分子と分子の間に働く分子間力です.分子間力は分子の内部に働く化学結合と比べると弱い化学結合です.
代表的な分子間力として水素結合とファンデルワールス力があります.
水素結合(Hydrogen bond)
水素結合は、水素原子が酸素、窒素、フッ素などの電気陰性原子に引き寄せられることによって生じる特殊な分子間力です.共有結合やイオン結合と比べると弱いですが、水、DNA、タンパク質などの化合物の構造や性質を決定する上で重要です.
水素結合は、電気的に陰性な原子に共有結合した水素原子が、近くにある別の電気的に陰性な原子に引き寄せられることで起こります.
高い沸点、表面張力、さまざまな物質を溶かす能力などの水のユニークな性質は水素結合によるものです.水素結合は、生体分子の構造と機能、例えばDNAの二重らせんの安定性や分子認識のプロセスにおいて重要な役割を果たしています.
固体中では、例えば結晶水を有する天然鉱物やヒドロキシル基を持つ酸化物などで見られます.
ファンデルワールス力(van der Waals force)
ファンデルワールス力には、ロンドン分散力、双極子-双極子相互作用、誘導双極子など、さまざまな分子間力が含まれます.これらの力は電子密度が一時的に揺らぐことで生じ、気体、液体、固体の挙動において重要な役割を果たします.
遷移金属ダイカルコゲナイドやグラファイトを筆頭とする層状化合物では、層間の結合がファンデルワールス力によって支えられています.ファンデルワールス力は弱いため、こうした層状化合物は原子一層まで剥離することが可能です.
まとめ
化学結合にも様々な起源があり、化学結合の多様性によって多種多様な物質が形成されます.一方、実際の物質における化学結合は決して単一の化学結合に帰する事のできるものではありません.完全にイオン結合性の物質は存在せず、完全に共有結合性の物質もありません.どの物質も種々の化学結合の特徴をある程度併せ持っているのです.
物質がどの程度の寄与で結合性を持っているかは、構成元素の電気陰性度によって推測が可能です.例えば、有名なケテラーの三角形では構成元素の電気陰性度の差と平均値によって共有結合性、イオン結合性、金属結合性を区別します.
参考文献
Bonding In Solids - Easy Electronics
11.8: Bonding in Solids - Chemistry LibreTexts
化学教育 1966 年 14 巻 1 号 p. 23-27