
更新 2024-2-23
塩化ナトリウム型構造(岩塩型構造、NaCl型構造、NaCl-type structure、rock salt structure)
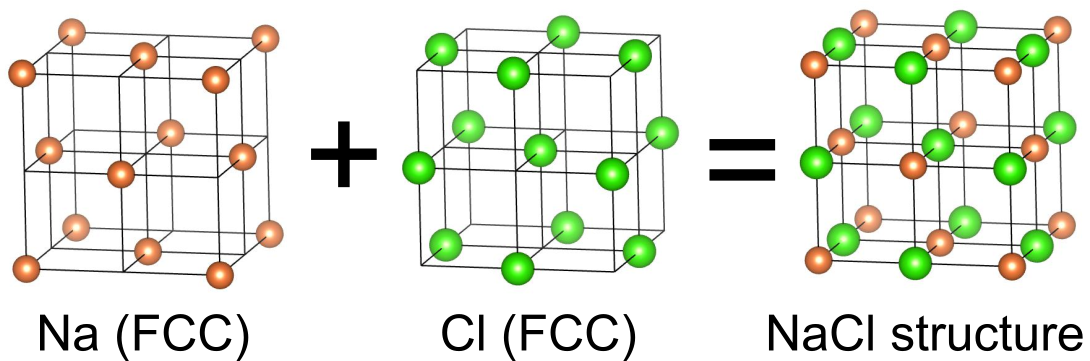
塩化ナトリウム型構造は、の組成で表される二元系物質の多くに見られる結晶構造であり、三次元空間に原子をチェッカーボード状に並べたような配置をしています.
単位胞にはと
がそれぞれ4つずつ含まれます.
は6つの
に配位され、
は6つの
に配位されています.
この結晶構造を記述する方法はいくつかあります.
- 塩化ナトリウム型構造(岩塩型構造、NaCl型構造、NaCl-type structure、rock salt structure)
- 塩化ナトリウム型構造を持つ物質の特徴
- 塩化ナトリウム型構造から派生する構造
- まとめ
- 参考文献
最密充填を基準とする方法
塩化ナトリウム型構造においてと
は等価なので、どちらを基準にしても良いのですが、大抵は陰イオンの
を基準にします.
は面心立方構造(立方最密充填)をとり、この八面体間隙全てに
を詰めると塩化ナトリウム型構造となります.この構造では
と
は両方とも面心立方構造の配置をしています.なお、面心立方構造の四面体間隙は空のままです.
多面体を基準にする方法
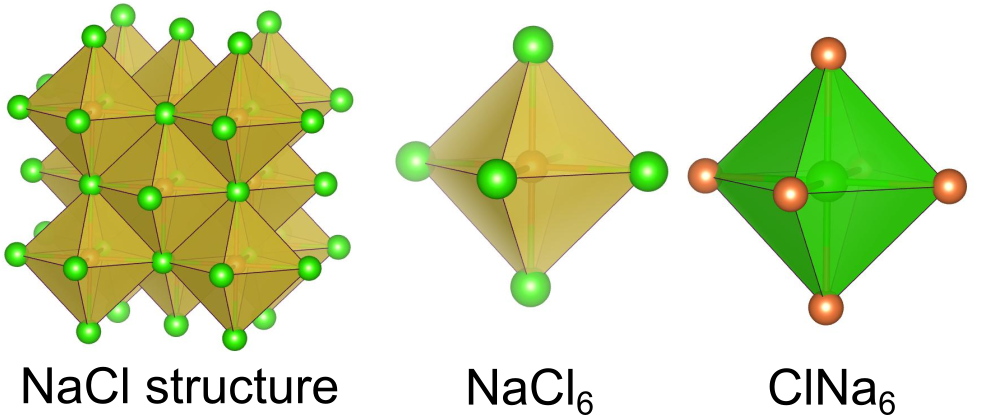
塩化ナトリウム型構造を持つ物質の特徴
塩化ナトリウム型構造では全ての八面体が辺を共有しています.ポーリングの第二法則によれば辺共有は点共有よりも安定性が落ちるはずですが、実際には多くの組成を持つ二元系物質が塩化ナトリウム型構造をとります.*1
辺共有とはいえ、塩化ナトリウム型構造では陽イオンと陰イオンの距離が程よく離れているため、多くのイオン結合性の物質が安定的に存在します.例えば、多くの酸化物、フッ化物、塩化物、水素化物が同構造の物質として存在します.イオン結合性の物質だけでなく、窒化物や炭化物を始めとした共有結合性の高い物質も知られています.
多くの塩化ナトリウム型物質は絶縁体ですが、や
など金属的な伝導を示すものもあります.
代表的な物質
TiNをはじめとした窒化物
、
などの塩化ナトリウム型窒化物は非常に硬く安定性が高いことから、工業用の部品や切削器具などに使用されます.また、これらは金属伝導を示すとともにいずれも低温で超伝導を示します.これらに限らず、遷移金属の窒化物は超伝導を示すものが多いです.
MgOをはじめとした酸化物
アルカリ土類金属はいずれも塩化ナトリウム型構造を持つ酸化物を形成します(周期表の上から、
、
、
).いずれも白色の絶縁体で、水と反応して水酸化物を生成するため塩基性です.酸化バリウムは毒性を示す一方、酸化マグネシウムは胃腸の調子を整える医薬品として使用されます.
NaHをはじめとした水素化物
アルカリ金属の水素化物はいずれも塩化ナトリウム型構造を持ちます.水素は通常カチオンの方が安定ですが、電気的陰性度の低いアルカリ金属との化合物では例外的にアニオンとして振る舞います.水に溶けると水素ガスとともに水酸化物を生成するため強い塩基性を示します.また、水素アニオンの還元力を生かして合成用の還元剤としても使用されます.
PbTe
をはじめとした14族元素が2価カチオンとして振る舞う時、孤立電子対の影響によって構造が理想的な多面体から歪むことが多くあります.
は例外的に歪んだ構造を示さず、対称性の高い塩化ナトリウム型構造をとります.その影響なのか定かではありませんが、
は高い熱電性能を示すことが知られています.
LaO
ランタノイドは基本的に3価のカチオンとなります.そのため、例外的に2価を取りうるを除いて、塩化ナトリウム型構造を持つランタノイドの酸化物は知られていませんでした.ところが最近、薄膜合成技術の進展により塩化ナトリウム型構造を持つランタノイド酸化物が続々と発見されました.これらは珍しい2価の価数をとるだけでなく、
は超伝導、
は重い有効質量の電子を持つなど、興味深い物性を示すものも多いです.
LaSbとLaBi
と
は金属的な伝導を示しますが、他には特に特徴のない物質であると思われていました.ところが2016年、両物質が極端に大きい磁気抵抗を示すことが報告されました.磁気抵抗とは、磁場をかけた際に電気抵抗が変化する現象で、普通の物質は数%程度の効果しか示しません.ところが、
は100万倍以上の極めて大きな磁気抵抗を示すことから注目を集めました.この大きな磁気抵抗は
の特異なバンド構造から説明が可能なようです.
塩化ナトリウム型構造から派生する構造
型構造では金属サイトは一種類の金属から構成されます.金属サイトを2種類の金属で占有することにより、新しい結晶構造が生成します.2種類の金属の片方が
や
などのアルカリ金属である場合は、電池材料として有名な物質がいくつか見られます.
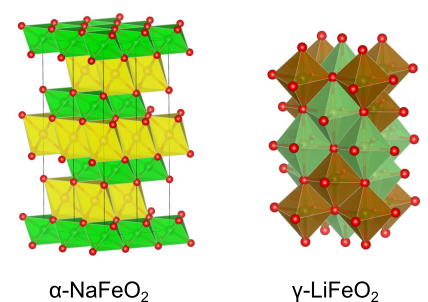
β-LiFeO2型構造、β-LiFeO2型構造、α-NaFeO2型構造
いずれも金属サイトに2種類の金属を1:1の組成比で秩序化した構造であり、それぞれの構造で秩序化のパターンが異なります.特に型構造は金属が層状に並んだ構造で、リチウムイオン電池の正極材料として有名な
が属します.
CdCl2型構造
金属サイトを型構造と同様に2種類に分けた上で、一方のサイトを空にしたような構造です.八面体空孔が占有された金属層と全く占有されていない金属層が交互に積層しています.
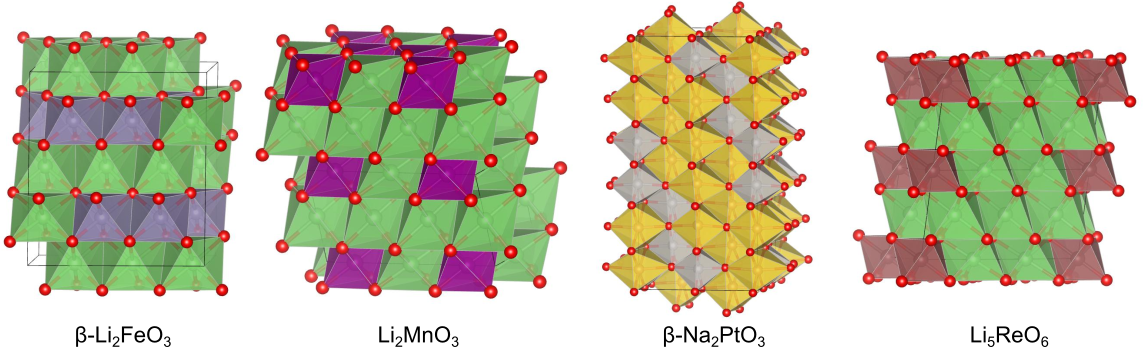
β-Li2SnO3型構造、Li2ZrO3型構造、β-Na2PtO3型構造
金属サイトに2種類の金属を2:1の組成比で秩序化させた構造です.はリチウムイオン電池の正極材料として近年注目されています.
Li5ReO6型構造、Li3Ni2TaO6型構造
金属サイトに2種類の金属を5:1の組成比で秩序化した構造です.
まとめ
型構造は、
の面心立方構造と
の面心立方構造を組み合わせた構造であり、結晶構造の中でも特に有名な一つです.多面体に着目すると、全ての八面体は辺を共有して三次元的なネットワークを形成しています.その対称性の高さに由来し、多種多様な物性が知られています.また、金属を秩序化させた派生構造はリチウムイオン電池やナトリウムイオン電池の電極材料としても有名です.教科書的な存在でありながら実用上も有用な
型構造は、今後も代表的な結晶構造であり続けることでしょう.
参考文献
Journal of the American Chemical Society, 2018, 140.22: 6754-6757.
Nature Physics, 2016, 12.3: 272-277.
New Journal of Physics, 2016, 18.8: 082002.
Journal of Materials Chemistry, 2000, 10.10: 2219-2230.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).
*1:ちなみに、全ての八面体が頂点を共有した構造はReO3型構造と呼ばれます.この構造はあまりにも体積密度が低いためか、報告されている物質数は多くありません.