更新 2024-2-23
ボルタ電池(Voltaic pile)
電池が現在のような形になるまでに、200年以上に渡る技術の進展がありました.最初に発明されたボルタ電池から、現代のリチウムイオンを思いつくことなんてできるのでしょうか.
ボルタ電池は有意な値の電圧を取り出すことのできる初めての電池として、電気分解反応によるアルカリ金属やアルカリ土類金属の精製に用いられました.
ボルタ電池は19世紀の終盤、イタリアの化学者Alessandro Voltaによって発明されました.電圧の単位V(ボルト)は、電池の発明者であるボルタの名に由来します.ボルタは電池の発明の他に、気体の研究でもメタンの発見をはじめとした顕著な業績があります.
ボルタ電池発明の少し前、イタリアのLuigi Galvaniが「動物電池」を発見しました.
なんだかグロテスクな響きのある文字列ですが、これはカエルの筋肉と金属を接触させることにより電気が取り出せることを見い出し、動物の中に電気の源があると解釈したものです.
動物電池の追試を行っていたボルタは、電気の源がカエルではなく、異なる金属の接触にあることを突き止めました.この考えを元に、ボルタは今日の電池の原型を作り上げました.
ボルタ電池とボルタ電堆(Voltaic pile)
ボルタ電池は高校の教科書でも題材になっており、馴染み深いものです.我々が教科書で教わるボルタ電池は、下図左のように亜鉛電極と銅電極が硫酸水溶液に浸った非常にシンプルな構造をしています.
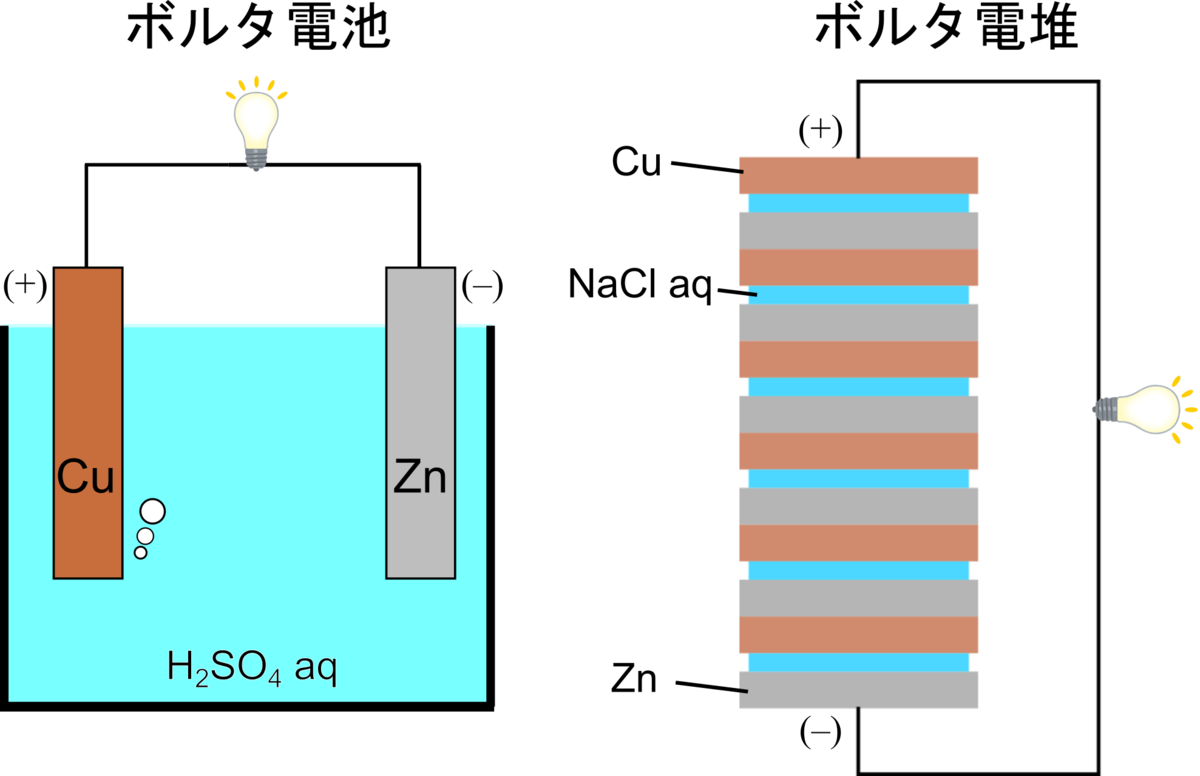
しかし、ボルタが発明した最初期の電池は、上図右のように現代の教科書にある電池とかけ離れた構造をしており、ボルタ電堆(英名:Voltaic pile)と呼ばれます.「pile」は堆積物や山を意味し、電池とは程遠い意味です.
ボルタ電堆は銅と亜鉛の金属板が、塩水に浸した布で仕切られ、交互に何重にも重ねた構造をしています.山の上下の接点を導線で接続することにより電流が流れ、重ねる金属層の数を増やすほど起電力が高くなります.当時はなぜ電位差が生じるのか解明することができず、電気化学分野の発展を待つ必要がありました.
ボルタ電堆は安定性に問題があったため、後に改良されボルタ電池が完成しました.
ボルタは「異種金属の接触により電気が発生すること」と「その大きさが金属の種類によって異なること」を見出し、イオン化傾向の原型とも言えるボルタ列を提唱しました.
ボルタ電池は、すぐに出力が低下してしまうことから実用材料としての応用は難しく、社会に浸透することはありませんでした.実用電池の進展はダニエル電池の登場を待ちます.とはいえ、ボルタ電池の歴史的な意義は大きく、現在でも教科書の題材として使用されています.
ボルタ電池は以上のように、銅と亜鉛と塩水を使用したものでしたが、いつしか日本の教科書では塩水の代わりに硫酸水溶液を用いた系が使用されることになりましたが、反応自体は殆ど変わりません.
ボルタ電池の反応
現代で教わるボルタ電池に戻り、どのような反応が起こっているかを見ていきましょう.電池の導入部であることからシンプルな反応であるように思いますが、実は大変複雑なことが起こっています.
現在では電池分野の導入としてはダニエル電池が使われ、ボルタ電池は参考資料として使われているらしいですが、理由はその複雑さにありそうです.
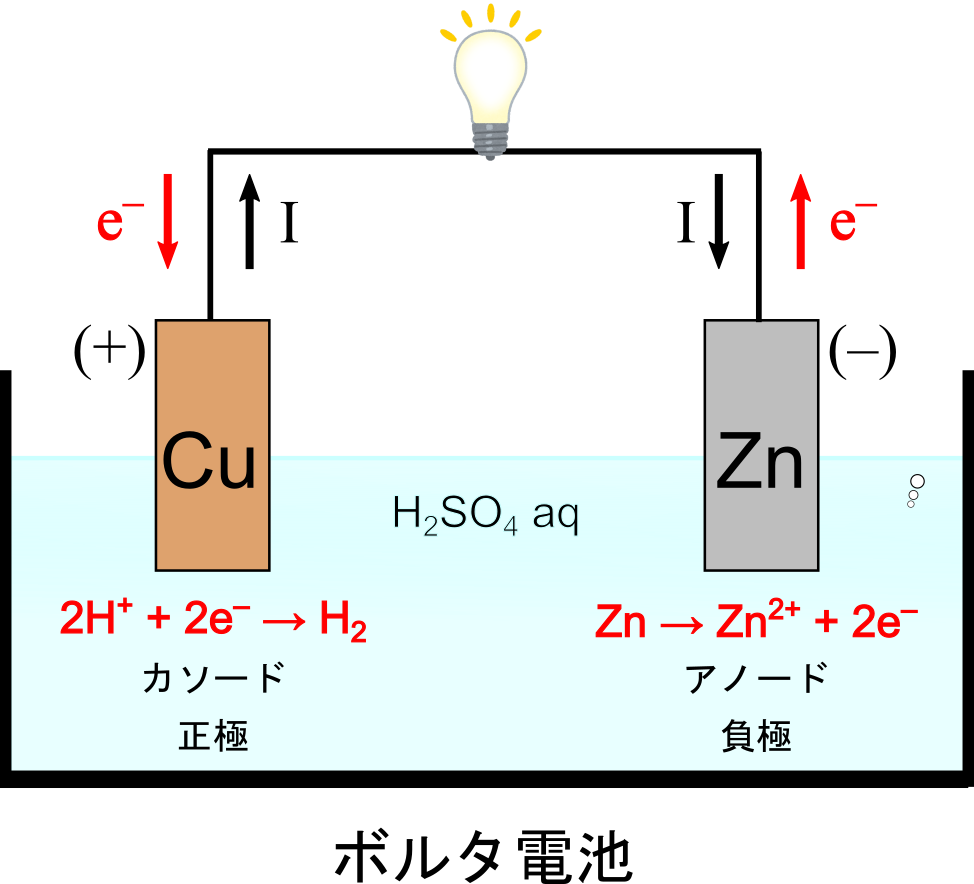
では、どのような反応が起こっているのでしょうか.まず、ボルタ電池の構成を確認します.電極として亜鉛および銅電極を用い、電極全体が硫酸水溶液に浸った構造をしているのでした.
亜鉛電極(アノード)は酸化反応が起こり、亜鉛イオンと電子が生成します.銅電極(カソード)では還元反応が起こり、水素イオンが還元されて水素分子が生成します.
反応式は以下のように表されます.
起電力を求めるには標準電極電位の値を用います.標準電極電位は、イオン化傾向を定量化した値であり、化学種の酸化されやすさ(還元されやすさ)を示す値です.(詳しくはこちらを参照)
常温、亜鉛イオンと水素イオンの濃度が1 mol/l程度、水素圧力が1 atm程度であれば、起電力は標準電極電位の差とおおむね一致します.
上記の亜鉛の反応、水素の反応の標準電極電位はそれぞれ-0.76 V、 0 Vであることから、電池の起電力は0.76 Vになるはずです.
しかし、高校では電池の起電力は1.1 V程度であると教わりました.
何がこのような違いをもたらすのでしょうか.考えられる原因はいくつかあります.
(1)濃度の変化
液中のイオンの濃度は反応が進むごとに変わるため、起電力も反応進行とともに変わります.反応初期は亜鉛イオン濃度が低いですが、反応が進行すると亜鉛イオンが増え、溶液に亜鉛イオンが溶けにくくなります.
溶液中の水素イオンは還元反応で消費されるため、反応進行に応じて水素イオン濃度が減っていきます.反応初期は起電力が高いですが、時間経過に連れて反応が起こりにくくなるため、起電力は低下していきます.
(2)酸化銅の還元
電極の表面反応は実際には上記のような理想的な反応では表せません.銅の電極の表面は一般に酸化銅(など)で覆われています.そのため、銅電極上の反応ではまず最初に酸化銅の還元が行われます.
(正極):
この反応の電極電位は+0.46 Vであり、水素イオンの標準電極電位よりも正に大きいため、電池の起電力は大きくなります.これが、反応開始時の電池の起電力が1 Vを超える理由の一つです.
(3)電極の触媒能
ボルタ電池の反応式を見れば明らかですが、銅自体は反応に寄与していません.銅の役割は「反応しにくい金属」程度の役割であり、銀や金を用いても問題はありません.
しかし、銅には別の役割があり、それは水素発生反応の触媒としての役割です.銅の代わりに水銀を用いると電池が作動せず、白金を用いるとより活性になりますが、これは水素発生反応の触媒能がそれぞれの金属で異なるためです.
(4)亜鉛の溶解
また、ボルタ電池で起こる反応はこれだけではありません.亜鉛を硫酸に入れるとどうなるでしょうか.当然、亜鉛が溶けて水素が発生します.
一見、電池全体の反応と同じですが、この反応は銅電極の存在とは無関係に起こります.つまり、起電力には全く貢献せず、ただ亜鉛が消耗しているだけです.これも起電力低下の原因になります.
(5)過電圧の影響
過電圧の影響も考慮する必要があります.過電圧とは、「電気反応を起こす際に電極電位から予想される値と実際に得られる値の差」を意味します.すなわち、実際の実験では理論値から予想されるよりも大きな電圧をかけなければ反応が進行しません.
過電圧の原因は多岐に渡りますが、電池の内部に電流を流すことに対する物理的・化学的な抵抗があるために生じます.実戦は理論通りにはいかないということですね.
ともかく、過電圧の影響により、起電力は電極電位から予想される値よりも小さくなります.
(6)分極(?)の影響
高校化学では、ボルタ電池の起電力低下の原因として「分極」という言葉が使われます.他の場所ではまず見かけない謎な言葉ですが、「銅電極が水素ガスで覆われるために起電力が低下する」ことを意味するようです.
起電力が低下する要因ははっきりしませんが、水素の吸着によって(3)の銅の触媒能が低下したためと考えられています.
分極は科学用語としては別の意味を持ち、ボルタ電池の文脈でのみ異なる意味で使用されているようです.
(7)減極剤の影響
(6)の分極を防ぐため、「減極剤(過酸化水素などの酸化剤)を用いて銅電極表面に吸着した水素を酸化する」との説明が見られます.酸化剤とは、他の物質を酸化しやすい物質であると同時に、自身が還元されやすい物質です.
銅電極表面には絶えず電子が流れ込んでくるわけで、酸化剤はわざわざ水素を酸化するよりも、電子によって直接的に還元される道を選びます.すなわち、減極剤をいれることで、電池反応の還元種が水素イオンから減極剤(酸化剤)に変わってしまいます.
まとめ
ボルタ電池は電池反応の基礎として教わりますが、実際は極めて複雑な反応が起こっています.反応式は一見単純そうですが、速度論、平衡論、過電圧、表面反応、触媒反応などを考慮しなければなりません.
実際にボルタ電池を作成すると、亜鉛からもガスが発生するなど、教科書には書いていない現象も多々起こります.ボルタの現役時代はその反応過程の理解にまでは至らず、ダニエル電池やルクランシェ電池の発展により電池反応への理解が進みました.今日では博物館と実験室以外で姿を見ることのないボルタ電池ですが、電気化学反応の端緒を開いた歴史的意義は極めて大きいです.
参考文献
化学と教育 1992 年 40 巻 2 号 p. 98-99
化学と教育 1997 年 45 巻 6 号 p. 332-335
化学と教育 1998 年 46 巻 10 号 p. 632-635
化学と教育 2017 年 65 巻 12 号 p. 616-619