更新 2024-2-23
ラチマー図(Latimer diagram)
酸化されやすい金属もあれば酸化されにくい金属もあります.酸化されやすい金属の中でも、安定な酸化数は金属によって異なります.
例えば、は1価の陽イオンになりやすいですが、
は2価の陽イオンになりやすく通常は1価にはなりません.酸化還元反応を扱う際に、ある金属に対してどの酸化数が安定か調べることは有意義です.
金属の酸化還元反応の進みやすさは、標準電極電位を考えればよいのでした.とはいえ、いちいち全ての酸化数について標準電極電位の表とにらめっこするのは手間であり、もう少し効率的な方法が欲しくなります.
ラチマー図は、複数の酸化状態を持つ化学種の標準電極電位を表現する(やや古典的であるものの)標準的な方法です.今回は、化学種の電気化学的安定性を知るために使用されるラチマー図について見ていきます.
ラチマー図とその見方
ラチマー図は、アメリカの化学者Wendell Mitchell Latimerによって考案されました.複数の酸化状態をとりうる化学種について、酸化数の大きい方から順番に左から右に並び、矢印でつなげます.

この矢印の上に、左から右の化学種へ還元される際の標準電位が書き込まれています.元素によって可能な酸化数は異なるため、ラチマー図中の酸化数は化学種によって異なる値が選ばれます.
電位の値は、強酸([H+] = 1 M、pH = 0)または強塩基([OH–] = 1 M、pH = 14)の標準条件下で測定された値を用います.上に示したのは、たくさんの酸化状態をとりうる元素の代表であるのラチマー図です(強酸条件で測定した値).
この図からどのようなことが分かるでしょうか.
ラチマー図から読み取れること
標準電位は、正であれば還元反応が熱力学的に優勢で、負であれば酸化反応が優勢なのでした.
ラチマー図を見るとの酸化数が+7から+2までは値が正であるので、還元反応が起こりやすく、価数が小さくなる方向に向かうことが予想できます.
一方、酸化数が+2から0の標準電位は負であるので、+2の方が安定です.
結局、は+2の酸化数がもっとも安定であることが予想できます.
具体的に書き下してみましょう.
の酸化数が+2から0になる反応は、
の酸化数が+4から+3になる反応は、
なお、強酸水溶液中の反応であるのでと
が顔を出します.
ラチマー図から計算できること
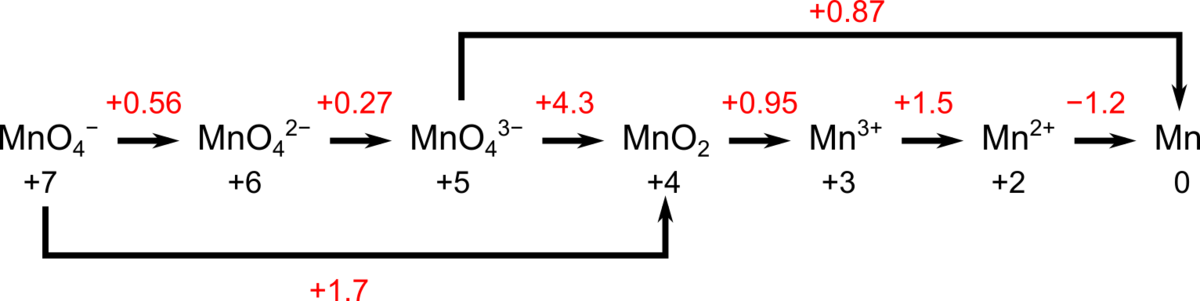
ここまでは図から自明ですが、ラチマー図からは複数の電子が関わった反応の標準電位を求めることが可能です.とはいえ、標準電位は加算可能な値ではないため、多電子反応の標準電位を求めるには工夫が必要です.
まず、標準ギブズエネルギー()の定義に立ち返り、
より標準電位をギブズエネルギーに変換します.なお、
はファラデー定数、
は反応に関わる電子の数です.
自由エネルギーは加算可能な量であるので、それぞれの反応のを足し合わせることによって、目的の多電子反応の
が求まります.最後に、この
から多電子反応の電子数を用いて標準電位を求めます.
の酸化数が+5から0になる反応の標準電位を求めてみましょう.
各電極電位とより反応のギブズエネルギー変化を合計すると、
関わる電子数は5であるので、
となります.
同様の手順により、様々な反応の標準電極電位を求めることが可能です.
まとめ
ラチマー図は使いこなせれば便利ですが、多電子反応の標準電極電位に計算が必要なのは手間です.というより、日常的にいちいち計算なんてやってられません(今どきわざわざ自力で計算する人なんていないでしょうけど).ラチマー図をより視覚的に分かりやすくした図として、フロスト図があります.
参考文献
4.4: Latimer and Frost Diagrams - Chemistry LibreTexts
シュライバー・アトキンス無機化学(上)第4版