酸化マンガン(Manganese Oxide)
初めてマンガン()という言葉を認識したのは小学校の理科だったかもしれません.二酸化マンガンに過酸化水素水を加えることで酸素が発生し、その酸素は水上置換法で集める・・・なんて覚えたような覚えなかったような.*1
最近はマンガン電池という言葉も聞かなくなってきているので、日常でマンガンという言葉に触れる機会もありません.しかし、マンガンは酸化物の形でリチウムイオン電池の正極材料や電子材料として使用されており、見えないところで私たちの生活を支えています.マンガン金属自体に目立った性質があるわけでもありませんが、酸化物など化合物となった瞬間に多彩な物性を示すようになります.
マンガンと酸素のみから構成される物質が酸化マンガンです.酸化マンガンは元のマンガンとは色も性質も全く異なります.二酸化マンガンが特に有名ですが、他にも様々な種類があり、マンガン元素の性質に由来するユニークな性質を示します.
今回は、様々な種類が存在する酸化マンガンの特徴と応用を見ていきます.
- 酸化マンガン(Manganese Oxide)
- マンガンの価数について
- Mn2+のみを含む酸化マンガン
- Mn2+とMn3+を含む酸化マンガン
- Mn3+のみを含む酸化マンガン
- Mn4+のみを含む酸化マンガン
- Mn7+のみを含む酸化マンガン Mn2O7
- まとめ
- 参考文献
マンガンの価数について
マンガンは多様な酸化数をとることのできる元素です.
酸素が2価の陰イオンとなることに注意すれば、例えば二酸化マンガン()は4価の陽イオン(
)となります.
その他にも、に対応する酸化物が存在します.
Mn2+のみを含む酸化マンガン
のみを含む酸化マンガンが
であり、緑色を示します.塩化ナトリウム型構造を持ち、
と
が互いに隣り合って並んでいます.
には高価数のマンガンがほんの少し含まれていることが多いようで、正確には
となっているようです.
は磁性材料として歴史的な物質です.
磁性材料には強磁性体と反強磁性体があります.原子の磁気の向きがすべて揃った強磁性体は磁気が外に現れますが、互い違いに並んだ反強磁性体では磁気を検出できません.そのため、反強磁性体は理論的には存在が確実視されていたものの、実験的な検出は困難でした.
そんな中、中性子を使った回折実験によって反強磁性を検出できるという理論が発表され、実際に実験的な反強磁性体の発見に至りました.この時の実験対象として選ばれたのがで、実質的に
は初めて発見された反強磁性体(転移温度 118 K)です.
は肥料や食品添加物として使用されるほか、大きな容量を持つ電池材料としても期待されています.
Mn2+とMn3+を含む酸化マンガン
には
と
が1:2の割合で含まれており、天然鉱物としてハウスマナイト(Hausmannite)の名で知られています.
マグネタイトと同様にスピネル型の結晶構造を持ちますが、室温では正方晶系(通常のスピネル構造は立方晶系)です.これは、を含むサイトがヤーン・テラー効果によって歪むことによって起こります.
は、エネルギーデバイス、バイオセンサー、医学、反応触媒、水処理プロセスなど、さまざまな分野での応用があります.
Mn3+のみを含む酸化マンガン
の組成を持つ酸化マンガンにはたくさんの物質があります.私の知る限りでは
から
まで存在し、それぞれ結晶構造が異なります.
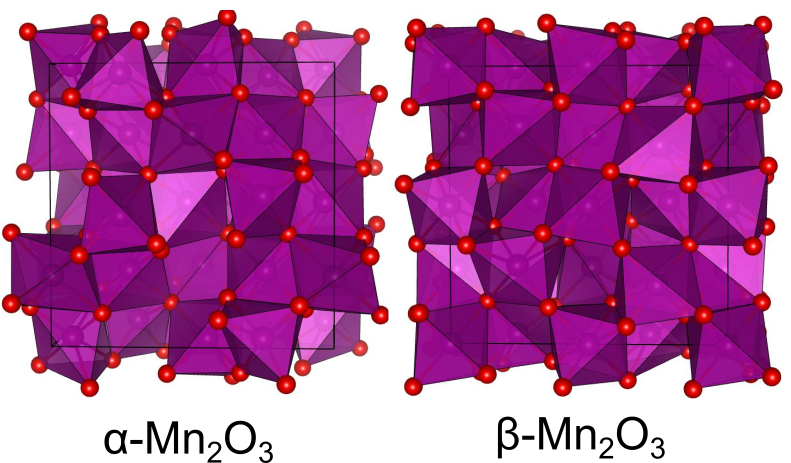
最初に発見されたのがビクスバイト型構造を持つで、転移温度90 Kの反強磁性体であるほか、酸化反応を促進する触媒として知られています.
は29 ℃を境に構造が変化し、高温ではビクスバイト型、低温では直方晶型の結晶構造になるようですが、この後者を指して、
と呼ぶ場合があるようです.ただし、高温側をβ、低温側をαと呼ぶような文献もあり、やや用法に混乱が見られます.
の結晶構造はスピネル構造に類似しています.合成が難しいようで研究はさほど多くありませんが、39 K以下でフェリ磁性を示すことが報告されています.一方、
に関する記述は見当たりません、
も見当たらなかったので、δという文字は使用されないものなのかもしれません.
2012年に発見されたばかりなのがと
です.これらはいずれも異なる価数のマンガンを含みます.
はイルメナイト型結晶構造を持ち、異なる結晶学サイトを
と
が占めます.
一方、はペロブスカイト型に近い結晶構造を持ちます.通常は金属が2種類含まれるペロブスカイト構造において、一種類の金属のみでペロブスカイトを形成するのはかなり異例なことです.様々な価数をとりうるマンガンだからこそできた芸当と言えるでしょう.
Mn4+のみを含む酸化マンガン
かの有名な二酸化マンガンがここで登場します.過酸化水素水と反応させたりアルカリ電池の材料となったりする二酸化マンガンです.と同じく、
にも様々な結晶構造(多形)が存在します.
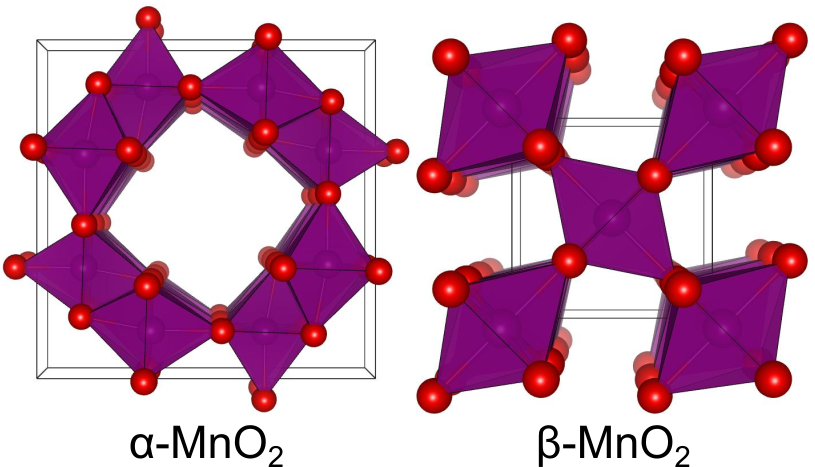
はトンネルのような一直線の穴が開いた構造をしており、この中に原子や分子を収容できます.この性質を活かし、リチウムイオン電池の正極材料としての応用が期待されています.
は軟マンガン鉱として天然に生成する鉱物で、最も安定な二酸化マンガンです.二酸化チタン(
)などと同様にルチル型の結晶構造を持ちます.酸化剤、触媒、電池材料などの用途で使用されています.中学の実験で使用したのもおそらくこの相でしょう.
また、層状構造を持つは電池材料や触媒などの機能を持つ材料として特に有力です.
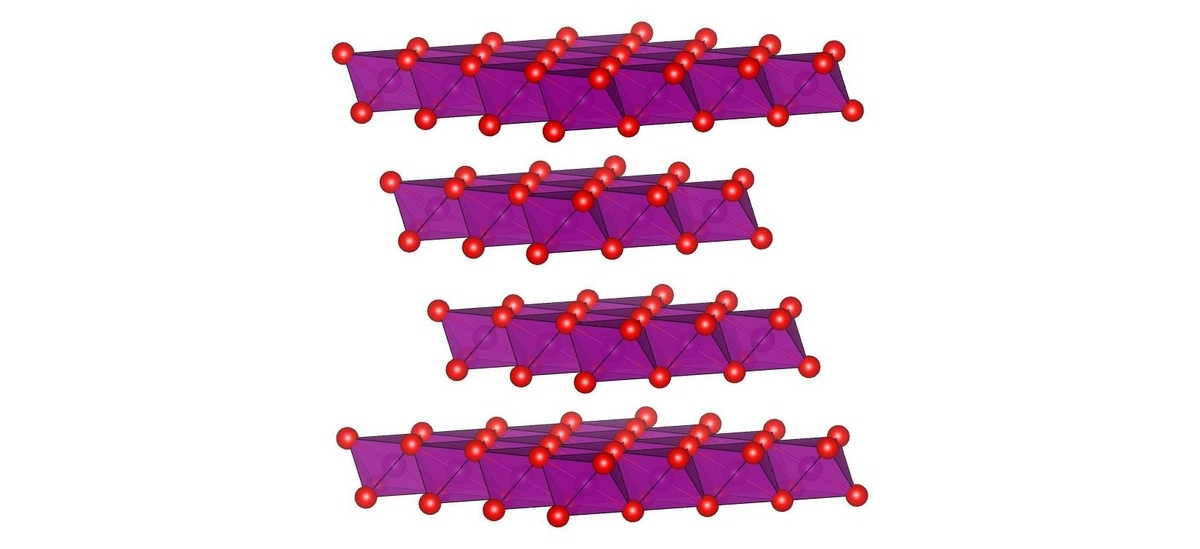
その他、多形としてと
、
が知られています.γ相は直方晶型、ε相は六方晶系、λ相は立方晶系の結晶構造を持ちます.いずれもそれほど安定ではないようで、加熱するとγ相とλ相はβ相へ、ε相は
へと構造が変わってしまうようです.
Mn7+のみを含む酸化マンガン Mn2O7
においてマンガンは7価というとんでもなく大きな価数をとります.この物質は室温では吸湿性・揮発性を示す不安定な油状の物質です.非常に強力な酸化性があり、高い腐食性を示します.当然ながら酸化剤として用いられます.
まとめ
マンガンと言えば二酸化マンガンが有名ですが、それだけではありません.単体では目立った性質のないマンガンですが、化合物となった瞬間に様々な磁気的、電気的、化学的な性質を示すようになります.その最も大きな特徴は様々な電荷をとりうることであり、一種類の金属元素のみでペロブスカイト型構造を形作ることができる元素は他にありません.
参考文献
"Growth of Crystals and Magnetic Properties of β‐Mn2O3 Solid Solutions." Journal of Applied Physics 37.3(1966): 1423-1424.
"Magnetic correlations and structure in bixbyite across the spin-glass transition." Physical Review B 100.14(2019): 144404.
"Ferrimagnetism in γ-manganese sesquioxide(γ-Mn2O3)nanoparticles." Journal of the Korean Physical Society 46(2005).
"Synthesis of Ilmenite-type ε-Mn2O3 and Its Properties." Inorganic Chemistry 60.17(2021): 13348-13358.
"Perovskite-like Mn2O3: A Path to New Manganites." Angewandte Chemie International Edition 52.5(2013): 1494-1498.
Mn2O7 - Solid State Chemistry @Aalto - Aalto University Wiki
電気化学 1953 年 21 巻 8 号 p. 367-375
化学と教育 2014 年 62 巻 5 号 p. 246-249
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).
*1:この二酸化マンガンとやらがどういう物質でどういう性質があるかは誰も教えてくれませんでした.今にして思えば触媒として働いていたのでしょう.