窒素の新しい同素体
同じ元素から構成されている単体のうち、互いに構造や性質が異なるものを同素体と呼びます. ともに炭素からなる黒鉛とダイヤモンドは最も有名な例と言えますが、炭素には他にもカーボンナノチューブやフラーレンなど様々な同素体が知られています.
特にグラフェンは21世紀になってから報告された物質科学の超新星であり、定期的に Natureに論文が掲載されるスーパースターです.
一方、周期表で炭素の隣に位置する窒素にはどのような同素体があるでしょうか.炭素の結合の手が4本あり多様な構造をとれることを考えると、手が3本の窒素はやや選択肢が限られているようにも感じます.実際、炭素と比べて窒素の同素体は多くないうえ、 報告されているものも極めて不安定なものばかりでした.
そんな中、2025年6月に、化学的に安定な窒素同素体の合成に関する報告がNature 誌に掲載されました.これまでの常識を覆した窒素同素体はどのような姿をしているのでしょう.過去の窒素同素体の歴史を振り返りながら、報告の内容を見ていきます.

窒素とその同素体
窒素分子()は空気中で最も豊富な化学種であり、成分の78%を占めます.原子同士をつなぐ三重結合は非常に強力で、化学的な反応性がほとんどありません.それゆえ、窒素は不活性雰囲気を作り出すためのガスとしてよく用いられます.
窒素分子が非常に安定であることこそが、窒素の同素体が希少である要因です.別の構造をとろうとしても、エネルギー的に安定な分子が先に生成してしまうのです.実際に、これまでに知られている窒素の同素体は化学的に不安定で、分解する際に膨大なエネルギーを放出して
分子へと還ってしまいます.

窒素のみからなる中性分子として知られているのは、1956年に気相中で回転分光法により同定されたアジドラジカル ()と2002年に報告された窒素4量体
です.後者は気相中性化・ 再イオン化質量分析法(Neutralization-reionization mass spectrometry, NRMS)によって検出された分子で、寿命が1マイクロ秒程度しかない上に構造は未決定です.1970年には水溶液中のアジドラジカルの分解過程で
種の存在が示唆されましたが、決定的な分光学的証拠は得られませんでした.(1)
また、から
までの分子状同素体(鎖状、環状、かご状など)を予測する計算結果がありますが、その多くは
への解離障壁が低いです.すなわち、極めて不安定であると予測されており、実際の合成報告例もありません.
電荷を持つものに対象を広げれば、アジ化物イオン () のほか、
などもあります.固体にまで手を伸ばせば、2000 K・110 GPという高温高圧環境でダイヤモンド構造をとる窒素相、
の2000 K以上・40 GP以上の条件下で観測された
ユニットなどが報告されています.(2)
そのような状況の中で、新しい窒素同素体として中性のが報告されました.この物質は理論的に予測されていましたが、窒素分子のような
ダイマーユニット持たないという特徴があります.(3)
新しい窒素同素体の合成
分子は、減圧下・室温でCLガスを固体
と反応させることで得られました.生成物の赤外線スペクトルは原材料とは明確に異なり、理論的に予測された
の特徴と一致することが分かりました.紫外光スペクトルも理論予測に合致しています.
同位体実験により分子内に2つのユニットが存在することが確認されました.液体窒素温度(77 K)で純粋な
をフィルムに調製することもできました.
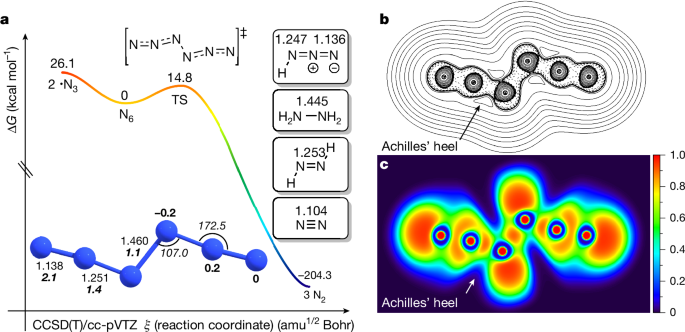
また、一見では真ん中の窒素(N3-N4)の間で結合が切れて分解しそうですが、実際には端の結合が弱点となり3つの窒素分子に分解しやすいとのことです.しかし、液体窒素温度では分解は起こりにくく、半減期は132年にものぼります.室温でも短時間であれば存在可能ですが、いったん分解が進むとその発熱量はえげつなく、TNTなどよりも大きなエネルギーを発するようです.
まとめ
窒素化合物には何かと物騒なイメージがつきものです.その一つの理由は、窒素分子の安定性に起因しており、不安定な高エネルギー状態にある窒素化合物が、分解時に安定なガスを生成することで、大量のエネルギーが急速に放出されます.また、分解反応で生成される
は、生成時に急激な体積増加をもたらし、周囲に地響きと衝撃波をもたらします.
実際、今回の報告論文においても著者らは実験の危険性を訴えており、「実験項」にはこれでもかとばかりの警告文が見られます.良い子はまねしないでね.
参考文献
(1)
"Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences 235.1200 (1956): 143-147
"Observation of azido radical by laser-induced fluorescence." Journal of Physical Chemistry 91.24 (1987): 6090-6092.
"Experimental detection of tetranitrogen. Science 295.5554 (2002): 480-481.
"Absorption spectra and kinetics of the intermediate produced from the decay of azide radicals." Journal of the American Chemical Society 92.25 (1970): 7486-7487.
(2)
"Searching for ways to create energetic materials based on polynitrogen compounds." Combustion, Explosion, and Shock Waves 46 (2010): 121-131.
"Theoretical study on "multilayer" nitrogen cages." The Journal of Physical Chemistry A 110.10 (2006): 3845-3852.
"N5+: a novel homoleptic polynitrogen ion as a high energy density material." Angewandte Chemie International Edition 38.13-14 (1999): 2004-2009.-
"Polynitrogen chemistry. Synthesis, characterization, and crystal structure of surprisingly stable fluoroantimonate salts of N5+. Journal of the American Chemical Society 123.26 (2001): 6308-6313.
E"Single-bonded cubic form of nitrogen." Nature materials 3.8 (2004): 558-563
"Cubic gauche polymeric nitrogen under ambient conditions." Nature communications 8.1 (2017): 930.
"Aromatic hexazine [N6] 4 anion featured in the complex structure of the high-pressure potassium nitrogen compound K9N56." Nature chemistry 15.5 (2023): 641-646.