イオン(Ion)、カチオン(Cation)、アニオン(Anion)
全ての物質は原子から構成されています.
原子はしばしば物質の最小構成要素として表現されますが、実際にはさらに小さな要素があり、正の電荷を持つ原子核と負の電荷を持つ電子から成ります.原子において原子核の持つ正電荷と電子の持つ負電荷の値は等しく、それゆえ原子は電荷を持たない中性物質です.
しかし、物質によっては正電荷と負電荷のバランスが崩れる場合があります.電荷を持つ原子をイオンと呼びます.正の電荷を直接的に担う陽子は原子核に束縛されており、原子から離れることはまずありえません.それゆえ、原子がイオンになる要因のほとんどは、電子が原子から去るか、新たに加わる場合です.
イオンは、原子の状態として非常にありふれており、陸海空、地球から宇宙まで、ゆりかごから墓場まであらゆる環境で見られます.食塩はイオンを含んだイオン結合性の物質ですし、電池はイオンを直接的に活用したデバイスです.
今回は、化学の基礎概念であるイオンについて見ていきましょう.
陽イオン(カチオン)と陰イオン(アニオン)
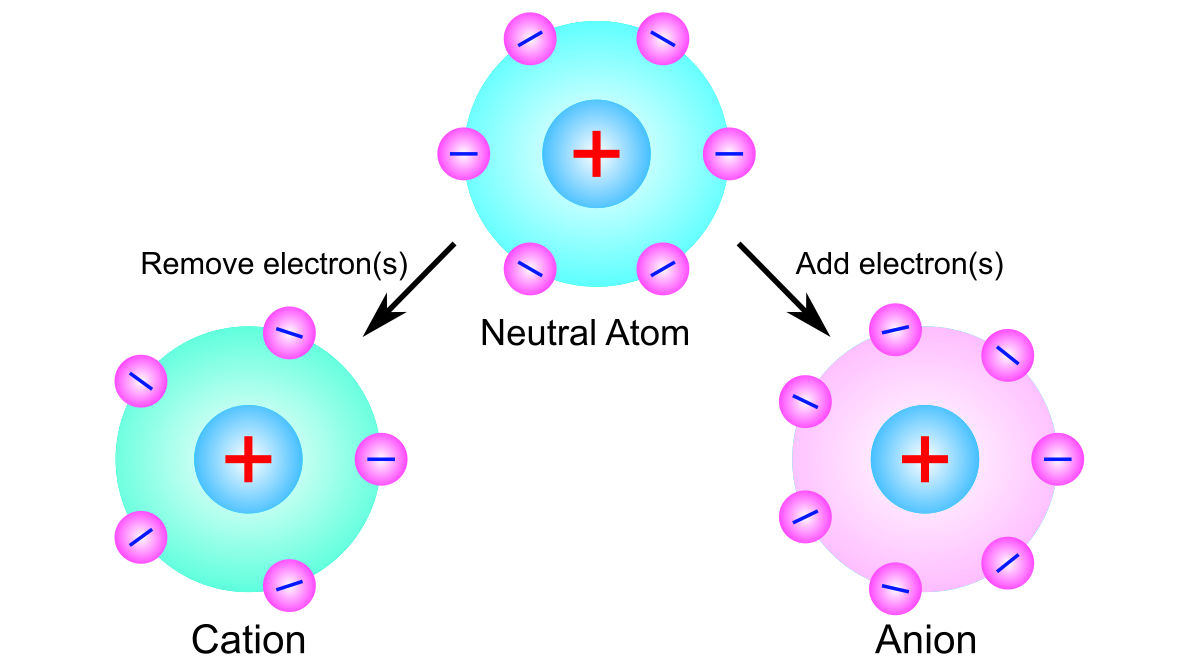
中性の原子において、電子が増減することで原子核と電子の電荷のバランスが崩れて帯電し、イオンとなります.イオン(Ion)は「行く」(to go)を意味するギリシャ語に由来し、反対符号を持つ電極に向かって移動する性質からその名がつけられました.
電子は負の電荷を持つので、電子の数が増えれば負の電荷を纏います.この状態を陰イオンあるいはアニオンと呼びます.逆に、電子の数が減れば、正の電荷を持つようになり、この状態を陽イオンあるいはカチオンと呼びます.
陽子の電荷は電子の電荷と同じ大きさなので、イオンの正味の電荷は、イオン中の陽子の数から電子の数を差し引いたものに等しくなります.
例えば、ナトリウム()から電子が一つ減ったナトリウムイオンは1価の陽イオンとなり、
と書きます.一方、塩素(
)に電子を加えた塩化物イオンは1価の陰イオンとなり、
と表されます.
陽イオン(カチオン)
陽イオンは正の電荷を持つイオンであり、「下」を意味するギリシャ語から由来したカチオン(Cation)の名でも呼ばれます.日本語では「カチオン」ですが、英語で「Cation」を読む場合は、カタイオンに近い発音となります.
陽イオンになりやすい原子を「電気的に陽性」と呼ぶ場合があり、周期表の左側に位置する原子が相当します.原子によっては、1つだけでなく複数の電子を手放すことで高価数の陽イオンとなります.例えば銀()は
, 亜鉛(
)は
となります.
電子を失い正の電荷を持つことで、原子核が電子をより引きつけるようになるため、陽イオンは元の原子よりも小さくなります.
陰イオン(アニオン)
陰イオンは負の電荷を持つイオンであり、「上」をを意味するギリシャ語から由来したアニオン(Anion)の名でも呼ばれます.カチオンと同様、英語で「Anion」と書いた時の発音はアナイオンに近いものとなります.
陰イオンになりやすいような「電気的に陰性」な原子は、周期表の右側で多く見られます.例えば、フッ素()は
、酸素(
)は
となります.
電子が増えることで電子一つあたりに働く原子核からのクーロン力が小さくなるため、陰イオンは基の原子よりも大きくなります.
カチオンとアニオンの性質
陽イオンと陰イオンは互いに逆の電荷を持つため、クーロン力によって互いに引き付け合います.電極反応では、この性質を利用してイオンを移動させ、電池として利用できます.また、陽イオンと陰イオン間のクーロン力を化学結合とみなした場合をイオン結合と呼び、や
などのイオン結合性の物質が知られています.
陽イオンになりやすい、あるいは陰イオンになりやすいという性質は何によって決まるのでしょうか.周期表を見たとき、一般的に左側に位置するほど陽イオンになりやすく、右側に位置するほど陰イオンになりやすいとされています.
この「イオンへのなりやすさ」を定量化するためのパラメータがいくつか知られています.「電気陰性度」や「イオン化傾向」などはその代表です.
詳しくは、以下の記事を参照してください.