更新 2024-2-23
ダイヤモンド構造(Diamond structure, Diamond cubic)とダイヤモンド(Diamond)
ダイヤモンドは宝石の代表例であり、装飾品として人気があると同時に非常に高価でもあります.

ダイヤモンドの発見は紀元前4世紀のインドにさかのぼり、シルクロードの道のりに沿って取引がなされていました.古くは装飾品のほか、切削工具や魔除け、さらには医療用具(接種すると傷が癒えると考えられたようです)としても使用されていました.
ダイヤモンドの需要と引き換えにインドの鉱脈は枯渇していきましたが、新しい鉱山も発見されました.19世紀後半には南アフリカで巨大な鉱床が発見され、世界のダイヤモンドの供給量は大幅に増加しました.供給過多に伴い一時期ダイヤモンドの価格は下落したものの、デビアス社のキャンペーンによって高級品のイメージが持ち直し、現在に至ります.
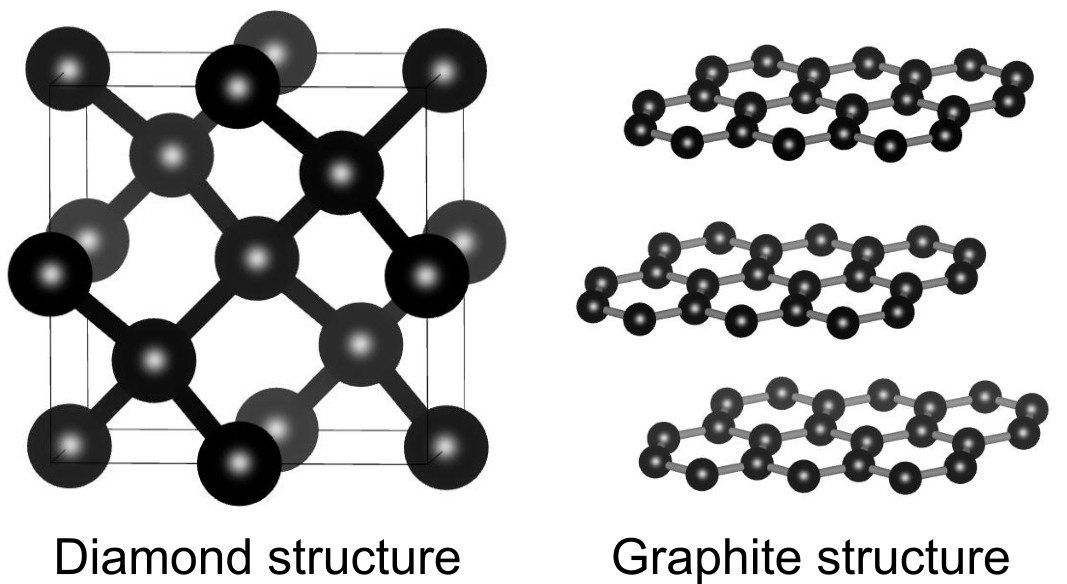
ダイヤモンドは炭素の同素体の一つです.組成は黒鉛と同じですが、結晶構造が異なるためダイヤモンドの見た目や性質は黒鉛とは大きく異なります.
ダイヤモンドは、炭素が地球奥深くで非常に高い圧力と温度にさらされることで生まれたものです.現在のダイヤモンドは、装飾品としての利用のほか、優れた硬さや熱伝導率、光学特性を活かして種々のデバイスに利用されています.
ダイヤモンドの結晶構造は「ダイヤモンド構造」と呼ばれ、他にもいくつかの単体元素で見られます.共有結合性が強く、一般にダイヤモンド構造を持つ物質は非常に「硬い」です.ダイヤモンドという言葉自体も古代ギリシア語で「打ち負かされないもの」を意味します.
今回は、ダイヤモンド構造のほか、ダイヤモンド自体についても見ていきます.
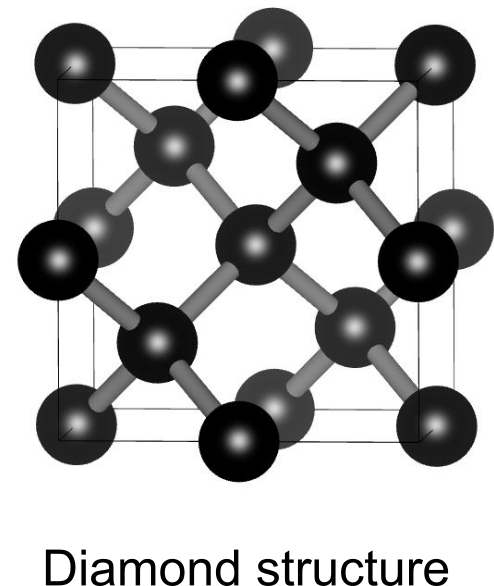
ダイヤモンド構造
ダイヤモンドの結晶構造は、炭素原子がダイヤモンド構造と呼ばれる三次元的なネットワークに沿って共有結合することで出来上がります.
全ての炭素原子はそれぞれ4つの炭素原子に正四面体型に結合されています.ダイヤモンド構造の単位胞は立方晶系であり、8つの炭素原子が含まれます.
ダイヤモンド構造を作るには、まず炭素の面心立方構造を考えます.この四面体間隙の半分に別の炭素原子を配置することによってダイヤモンド構造となります.あるいは、炭素の面心立方構造2セットを格子定数の4分の1だけずらして並べた構造であるとも言えます.
最密充填構造に比べるとダイヤモンド構造は遥かに「スカスカ」であり充填率は0.34程度です.それでも層状構造の黒鉛に比べると密度が大きいので、ダイヤモンドは地球の奥底のような高温高圧でのみ安定する構造です.
ダイヤモンド構造は、ダイヤモンド(炭素)以外の物質で見られます.14族元素はダイヤモンド構造になる傾向にあり、シリコンやゲルマニウム、スズが同構造をとります.
また、ダイヤモンド構造を2種類の元素によって配列することで、閃亜鉛鉱型構造が得られます.
ダイヤモンド
上述の通りダイヤモンドは炭素の同素体であり、炭素の共有結合による強固な結合ネットワークを持ちます.ダイヤモンドは地球上で生成される物質の中で最も硬く、大きな熱伝導率と屈折率を誇ります.これらの際立った性質は工学分野で重宝されています.
ダイヤモンドの合成
天然のダイヤモンドは地中奥深くで数億年スケールの時間をかけて生成されますが、近年では人工的に合成する技術が確立されています.
現在、市場にあるダイヤモンドの9割以上は合成品です.合成品は天然品よりも品質面で優れており、工学的な用途では専ら合成品が使用されます.
ダイヤモンドの人工合成は20世紀中頃に成功しました.代表的な合成法は、地中でダイヤモンドを形成するのと同じように高温高圧の条件で合成を行う手法です.この高温高圧法により単結晶・粉末ダイヤモンドが得られます.
また、化学気相法による合成も盛んです.これはメタンなどの炭化水素を熱・プラズマにより分解し、炭化水素中の炭素を基盤の上にダイヤモンドとして堆積させる方法です.
現在も高温高圧法と化学気相法による製法が主流ですが、爆薬のエネルギーを利用してナノサイズのダイヤモンド粒を作る方法等も提案されています.
ダイヤモンドの物性
硬度と強度
ダイヤモンドは、炭素の共有結合による強固な結合ネットワークにより非常に強固で堅牢です.
物質の硬度を評価する手法としてビッカース硬度とモース硬度が知られていますが、ダイヤモンドはどちらの指標でも天然物質の中で最も高い値を示します.そのため傷がつきにくく、物持ちの良い宝石材料として好まれます.安定性が高く、切削工具や耐摩耗部品としても有用です.しかし、高温で鉄やニッケル等とは反応する他、高温では酸素によって酸化する点に注意が必要です.
ダイヤモンドは非常に硬いため、加工にもダイヤモンドが使用されます.ダイヤモンドは硬いとはいえ、特定の方向には容易にへき開します.また、摩耗しやすい方向としにくい方向が存在します.
この特性を利用し、ダイヤモンドの摩耗しにくい方向に沿って粒子をカッターに塗布することで、ダイヤモンドでさえ切断可能なカッターとなります.
また、圧力に対して極めて頑強であるため、超高圧環境を作り出すダイヤモンドアンヴィルにも使用されます.
電気伝導性
ダイヤモンドは優れた絶縁体であり、電気を全く通しません(バンドギャップ 5.6 eV).
ダイヤモンド構造中では炭素の4つの価電子が共有結合に使用されており、電子は全く身動きが取れません.しかし、ここに微量のホウ素(B)を置換する(ドープする)ことで電気伝導性が生まれ、半導体や金属の性質を持たせることが可能です.ホウ素は炭素よりも価電子数が1つ少ないため電子の占める席に空席が生まれ、この空席に電子が順番に椅子取りゲームすることによって電子が流れるというわけです(p型半導体).
他にも、炭素に電子数の1つ多いリン(P)をドープすることで余分な電子が伝導するn型半導体のダイヤモンドも合成可能です.
ドーピングによって電子伝導性を持たせたダイヤモンドには多くの応用先があります.大きなバンドギャップを生かしたパワー半導体材料や、化学的安定性が極めて高いことを生かした電極材料に使用されます.
また、ホウ素を多量にドープしたダイヤモンドは超伝導を示すことが報告されています.[a]
その他の物性
ダイヤモンドの熱伝導率は 2200 W/mK であり、全ての物質中で最大の値を示します.この高い熱伝導率は、排熱の用途や熱プローブとして利用されます.
ダイヤモンドの格子中に窒素(N)と空孔が入り込んで形成した欠陥はダイヤモンドにピンク色に近い色をもたせます(色中心).この色中心は、室温で単一のNV中心が持つスピンを観測でき、長いスピンコヒーレンス時間を持ちます.
詳しくは割愛しますが、この特性により超感度量子センサーや量子情報デバイスとしての用途が期待されています.[b]
まとめ
ダイヤモンドは宝石としてはそれほど身近ではないかもしれませんが、工業的には非常に重要な存在です.炭素により強固なネットワークはダイヤモンドを頑強なものとしており、硬度や強度を生かした工業分野でダイヤモンドが使用されます.強度以外にも電気伝導性、熱伝導性、光特性などオンリーワンの特性が豊富であり、産業的にも学術的にも今なお重要な物質であり続けています.
宝石の天然ダイヤモンドを手にするのはいつの日か分かりませんが、それまでは工業用の人工ダイヤモンドで我慢しましょう.
参考文献
精密工学会誌 2012 年 78 巻 3 号 p. 212-215
化学と教育 2008 年 56 巻 12 号 p. 606-609
Material properties of diamond - Wikipedia
History of Diamonds, Where Do Diamonds Come From
水落憲和准教授インタビュー - ようこそ量子 - 量子情報の最先端をつたえるInterview#004
応用物理 2018 年 87 巻 4 号 p. 251-261
[a] Nature, 2004, 428.6982: 542-545.
[b] Physics Reports, 2013, 528.1: 1-45.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).