更新 2024-2-23
電気陰性度(Electronegativity)
電気陰性度は「原子が電子を引き付ける強さの指標」を意味します.
化学結合から物質の反応性まであらゆる分野に顔を出す極めて重要な概念ですが、とらえどころのない量であるのも確かです.具体的な例から考えていきましょう.
「原子が電子を引き付ける強さ」
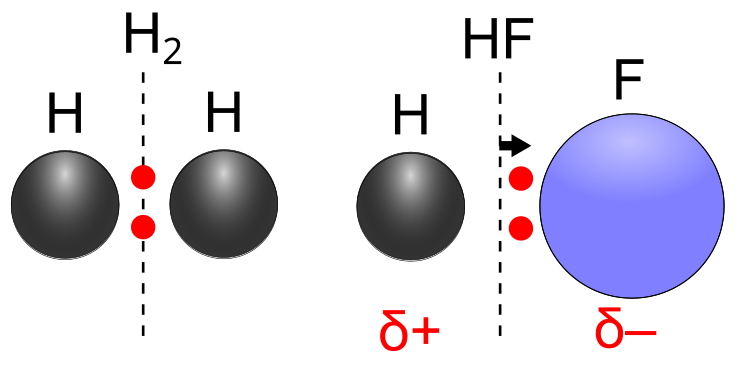
化合物において、原子と原子の間には必ず電子があります.水素分子()中では、二つの
の間で電子対を共有している(共有結合)のですが、その電子はどこに存在しているでしょうか.
二つの原子は等価なので、当然、電子を引き付ける力も同じです.
結局、電子対は二つの原子のちょうど真ん中に存在することになります.時間によって位置は変動しますが、平均すると真ん中にあると考えてよいでしょう.
次に、フッ化水素分子()について考えます.今回は原子の種類が異なるため、電子を引っ張る力もそれぞれ違います.電子対もどちらかの原子に偏って存在することが予想できます.
は「原子が電子を引き付ける強さ」が特に大きく、
で共有された電子対は
の方に大きく偏って存在しています.
続いて、二つの原子に極端に大きな「原子が電子を引き付ける強さ」の差があるケースを考えてみます.
例えば、塩化ナトリウム()ではどうでしょう.
の電子吸引力が
を圧倒しており、もはや電子対を共有なんて甘っちょろいことを言ってられず、
の全ての最外殻電子が
に奪われてしまいます.この状態をイオン結合と呼びます.こうなると、
と
に価数を割り振ることができ
と
となります.
ある二元系の物質を考えたときに、二つの原子の間の「原子が電子を引き付ける強さ」の差を考えることで、結合が共有結合であるかイオン結合(あるいはその中間)であるかを予測することが可能になります.
共有結合性物質とイオン結合性物質のどちらも固く、高融点で絶縁性という特徴は共通していますが、後者は極性溶媒(水など)に溶けやすいなどの差異があります.
各原子の電気陰性度の値が分かれば、化合物の性質を予想できるようになるので非常に便利です.こうして「原子が電子を引き付ける強さ」に「電気陰性度」という名前が与えられることになりました.
電気陰性度をどう定義するか
しかしながら、「原子が電子を引き付ける強さ」=「電気陰性度」をどう定義すれば良いでしょうか.
まずは「原子が電子を引き付ける強さ」を尺度として定式化する必要があります.何を測定すれば、「原子が電子を引き付ける強さ」と呼べるでしょうか.
実は19世紀以前から電気陰性度の概念自体はあったのですが、具体的な定式化は1932年に Linus Pauling によって行われました.
のちにノーベル化学賞を受賞することになる化学の巨人は「原子が電子を引き付ける強さ」として化合物の結合解離エネルギーに目を付けました.結合解離エネルギーはある結合を切り離すのに必要なエネルギーですので、そのまま結合の強さの指標になります.
二つの原子(AとB)が1:1の化合物を形成するケースを考えます.もしも生成した化合物における結合(A–B 結合)が単体における結合( A–A および B–B 結合)よりも大きな結合解離エネルギーをもっているならば、A–B結合は単体よりも強い結合を形成しているはずです.このように考え、ポーリングは二つの原子(AとB)の電気陰性度(χ)の差を、以下のように定式化しました.
ここで、は
結合の結合解離エネルギーです.
は値を無次元にするために導入されています.電気陰性度は無次元の尺度です.
さて、この式では電気陰性度の差しか求められません.具体的な値を与えるには、基準となる点が必要になります.ここでは[tex:\rm{H}]が基準として選ばれ、2.2 という値を持つことになりました.は陽イオンにも陰イオンにもなれる性質を持ち、おおよそ真ん中ぐらいの値の基準として適当だったのでしょう.
ポーリングの電気陰性度の値は A. L. Allred らが1961年に改訂し、今日までそれが使用されています.具体的な値は調べれば出てきますが、例えば以下のページは電気陰性度の表が直接出てきて便利です.
PERIODIC TABLE | ELECTRONEGATIVITY | NOBLE GASES: PAULING ELECTRONEGATIVITY VALUES
改めてしげしげと眺めてみると、新たな発見があるかもしれません.
周期表と電気陰性度
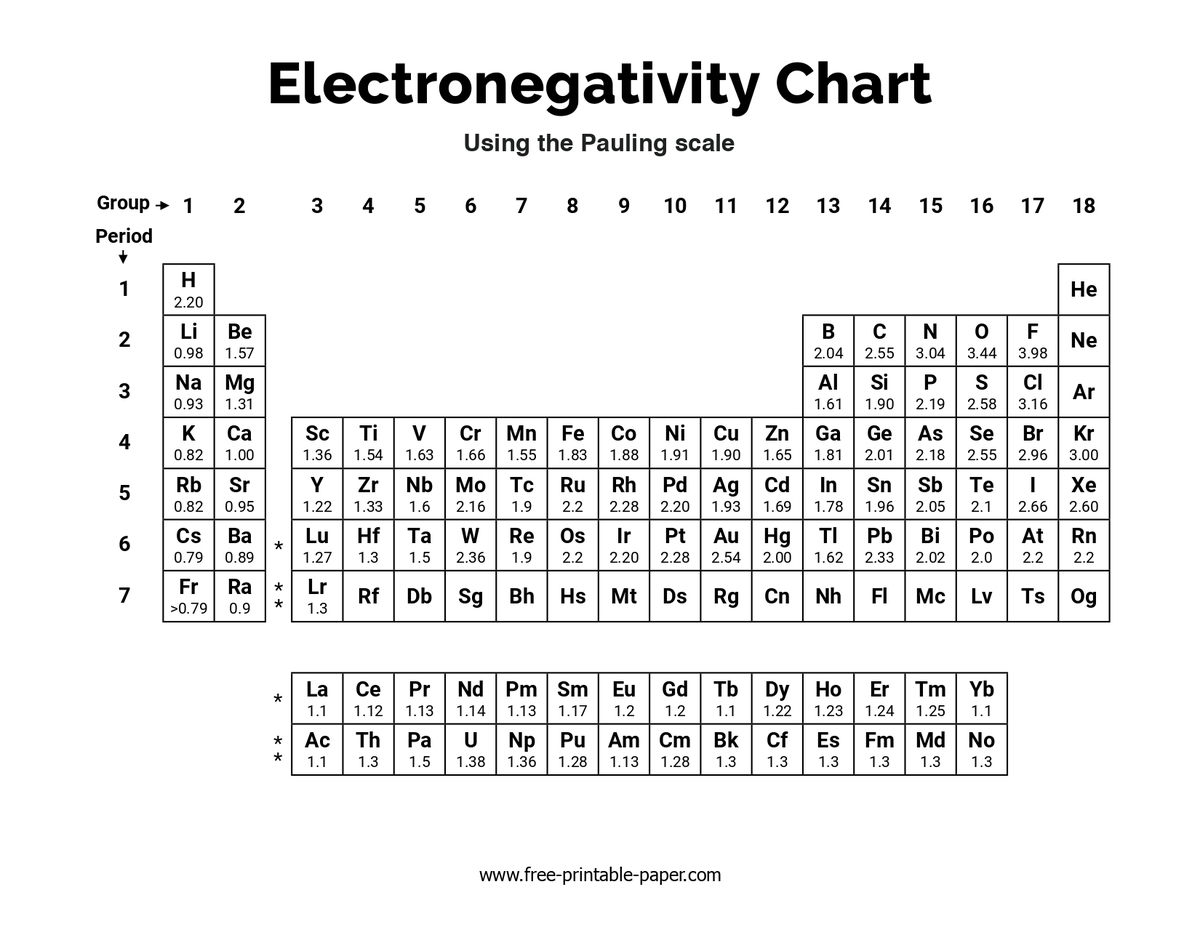
さて、高校化学では電気陰性度について以下のようなことを習いました.「周期表の右上に行くほど電気陰性度は大きくなり、左下にいくほど小さくなる(希ガスは除く)」
本当か確認してみましょう.
右上のの電気陰性度は 3.98 であり,全元素中で最大の値を示します.すなわち、最も陰イオンになりやすい元素が
です.この大きな電気陰性度によって、フッ素は炭素と強力な結合を形成します.一方、周期表の左下にあるのは
で、電気陰性度は最低値の 0.7 です.恐ろしく希少で高価な元素なので扱ったことのある人はほとんどいないでしょう.
このように、確かに電気陰性度は左下で最低値、右上で最高値を示します.この、0.7〜3.98というわずかな数値の間にすべての元素の電気陰性度が位置しています.一方、周期表の本当の右端、希ガス元素では電気陰性度が値を持ちません.これらの元素は閉殻であり、新しい電子を必要としないのです.
経験的に、電気陰性度が 2.5 以上あれば十分に陰イオンになる資格があり、反対に1.5以下の元素では陽イオンにしかなれないようです.ではその間の元素はどうでしょうか?環境によって陽イオン的にふるまう場合もあれば陰イオン的に振る舞う場合もあります.
教科書の正しさを確認したところで、もっと注意深く表を眺めてみましょう.
同一周期を右に行くと電気陰性度は大きくなっていきますが、特定の位置で特異的に大きな値を持つ元素があることが分かります.ほとんどの元素は電気陰性度が1〜3の間にありますが、右に向かって単調増加するわけでもなく、規則性が分からなくなってきます.規則性のないところが一番気になるのに、解説してくれる文献が全然なくて困ります.
主な違和感は以下のような点でしょうか.
の電気陰性度が他のアルカリ金属に比べて高い
や
の電気陰性度がけっこう高い
や
の電気陰性度がやけに高い
や
の電気陰性度がやけに高い
なぜこのようなことになるのか理由を探っていきましょう.
1.H の電気陰性度
第一族元素を見ていきます.などのアルカリ金属はどれも電気陰性度が小さいですが、水素だけ特異的に大きな値を示しています.
まず、なぜアルカリ金属の電気陰性度が低いのかといえば、イオン化エネルギーが低く、電子を加えても容易には閉殻になれないからです.アルカリ金属にせっせと電子を渡しても閉殻までの道のりは長く、最小でも7個の電子が必要です.
では、はどうでしょうか.水素は宇宙に最も豊富に存在する元素ながら、多くの例外を持つ特殊な元素です.
には内殻電子がありません.一つ電子がなくなれば、剥き出しの原子核が出てきます.他の電子による遮蔽(他の電子が原子核の正電荷を実効的に弱めること)がないため、他のアルカリ金属よりも電気陰性度が大きくなります.水素の電子を追い出した状態(プロトン)は存在しますが、他のアルカリ金属よりは生成しにくいということになります.
また、水素が一つの電子を受け入れた場合、ヘリウムの原子核と同じになり、閉殻となります.他のアルカリ金属と違って、たった一つの電子で閉殻に事足りるわけです.よって、水素は水素アニオン(ヒドリド)を形成することができ、水素の電気陰性度が比較的高い理由となります.
2.PbやBiの電気陰性度
や
は陽イオンとして扱われることが多く、
や
などの酸化物を形成します.しかし、周期表における属は
や
と同じであり、電子数から見れば閉殻に必要な電子数は少なく、電気陰性度が大きくなる理由は十分にあります.では、なぜ陽イオンになりやすいのでしょうか.
や
は重元素であり、原子核と最外殻電子の間に多くの電子軌道が存在します.そのため、最外殻電子への遮蔽(=原子核の正電荷が他の電子によって打ち消され、弱められること)が大きくなり、電子を手放して陽イオンになる傾向が強くなります.
一方で,電気陰性度の低い元素との化合物では陽イオンとして振舞う場合があり、 や
などの物質が知られています.これらはジントル相の一種としても知られます.
3.AuやPtの電気陰性度
周期表の右端に存在するわけでもないのに、や
は特異的に高い電気陰性度を示します.不思議な話ですが、電子配置を考えれば納得できます.
に一つ電子が加わった際、あるいは
に二つ電子が加わった際の電子配置は[Xe] (4f)14(5d)9(6s)2 であり、d 軌道とf軌道が閉殻になることがわかります.p軌道が閉殻になるときほどのインパクトはありませんが、それでも安定化に十分な寄与をします.
実際、金や白金を陰イオンとして含む物質がいくつか知られています.
4.MoやWの電気陰性度
最も謎なのがこれらの元素です.の電気陰性度は2.36であり、
よりも高い値を示します.しかし,私の知る限り、
や
を陰イオンとして含む物質はありません.
考えられる理由としては、
が陰イオンになった際に電子配置は、[Xe](6s)2(4f)14(5d)5となり、軌道が半閉殻にはなるため
も
も化合物中で高価数(6価)を取りやすく、ポーリングの定義では電気陰性度が高く見積もられやすい
など考えられますが、これだけで十分な安定化を得られるのでしょうか.
電気陰性度の計算方法に問題があるのでしょうか.上述のポーリング電気陰性度の計算方法は合理的ですが、必然性はありません.実際、ポーリング以後も様々な電気陰性度の定義が考案されています.
様々な電気陰性度の定義
有名なのは、Robert S. Mullikenによる定義です.Mullikenはイオン化エネルギー(IA)と電子親和力(EA)の算術平均から電気陰性度を算出しています.
1934年に提唱されました.Mullikenも後にノーベル化学賞を受賞しています.
一方,A. Louis AllredとEugene G. Rochowは、原子表面の電場の強さにより電気陰性度を定義しました.ここでは、 価電子に対する有効核電荷と原子の共有結合半径をパラメータに用います.
Leland C. Allenは、原子の価電子の平均エネルギーを用いて電気陰性度を定義し、軌道エネルギーを価電子数で加重平均した値を尺度に用いました.
それぞれの定義によって各元素の電気陰性度の値が異なることが分かるはずです.とはいえ、先駆者への敬意を表してか、どの定義においてもフッ素の電気陰性度がおよそ4になるように統一がされています.
Allenの定義では、や
も他の金属元素と遜色ない電気陰性度を示しています.(その分,希ガスの電気陰性度が高いという問題点があります.)
電気陰性度の値はそれぞれの定義で一意に定まりますが、電気陰性度の定義「電子を引き寄せる強さ」に立ち返れば、当然、原子の状態によって値は変化します.つまり、近くにある原子によって電子密度が変化すれば、電気陰性度の値もそれに応じて変化するはずです.
しかし、原子の状態によって電気陰性度を定義することは難しく、現在でも研究の最前線では上記のような電気陰性度の値が使われています.
電気陰性度のこれから
これまでは間接的な手法で求めるしかなかった電気陰性度ですが、最近では測定技術の進歩によって、物質中の電気陰性度を直接的に測定することが可能となっています.
東京大学のグループは、原子間力顕微鏡を用いて固体表面上の原子一つひとつに対して電気陰性度を測定することに成功しています.これにより、例えば単体のシリコンと酸化物中のシリコンでは異なる電気陰性度の値を示すことが分かりました.
東京大学、原子一個の電気陰性度の測定に成功:原子間力顕微鏡を活用 - EE Times Japan
将来的には、実験的に決められた電気陰性度の値が基準に使われていくのかもしれません.しかし、それでも先駆者の提唱した電気陰性度が意義を失うことはないでしょう.