更新 2024-2-25
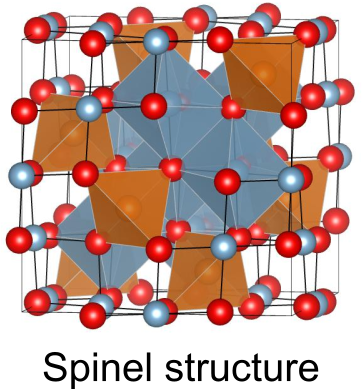
スピネル構造(Spinel structure)
スピネルとは、マグネシウム()とアルミニウム(
)からなる酸化物の天然鉱物であり、
の組成で表されます.
スピネルには赤や青など様々な色の輝きを示す鉱物が知られており、宝石として利用されます.スピネルの名はラテン語の「背骨、棘」(spinella)に由来し、スピネルが尖った結晶であることを示します.
スピネルの結晶構造をスピネル構造とよび、の組成を持つ三元系物質でよく見られます.酸化物だけではなく、硫化物や窒化物でもスピネル構造をとる物質が知られています.スピネル構造の単位胞には8つの
、16の
、32の
が含まれており、合計48の原子が入った複雑な構造をしています.
かなり複雑な構造であり、実際、立体的に理解するのはなかなか難しいです.以下では2種類の方法でスピネル構造を記述していきます.
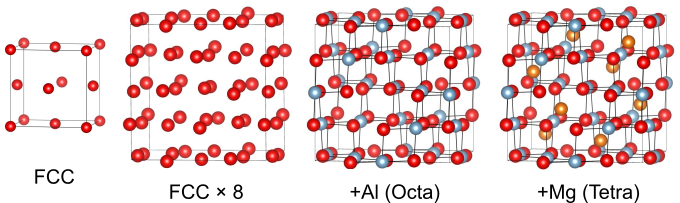
面心立方構造を基準とする方法
スピネル構造において、酸素原子は面心立方構造をとっています.面心立方構造の単位胞を2×2×2倍にすることで、スピネル構造の単位胞の大きさになります.
ここで、面心立方構造には八面体間隙が単位胞あたり4つあったことを思い出します.
この間隙をすべて埋めると塩化ナトリウム構造になりますが、スピネル構造ではこのうちの半分をAlで埋めます.
続いて、面心立方構造にある四面体間隙の8分の1をで埋めます.この際、
と
が可能な限り離れた位置になるように配置することで、スピネル構造となります.
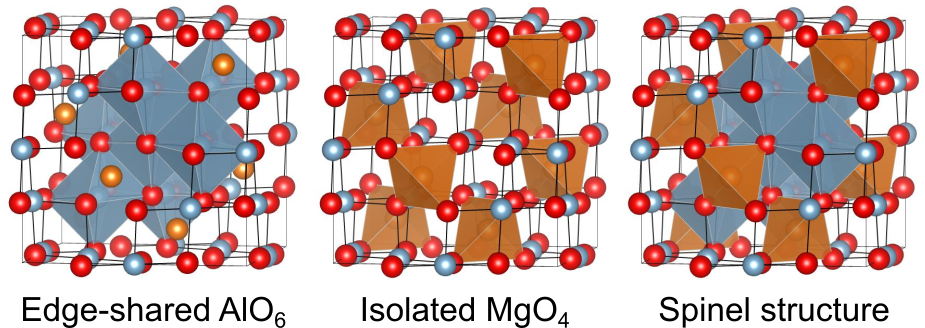
多面体を基準にする方法
スピネル構造において、は
に四面体配位、
は
に八面体配位をされています.
八面体は、互いに辺共有をしながら三次元的なネットワークを形成しています.
一方、四面体同士にはつながりがありません.
四面体と
八面体同士は、互いに頂点を共有しています.
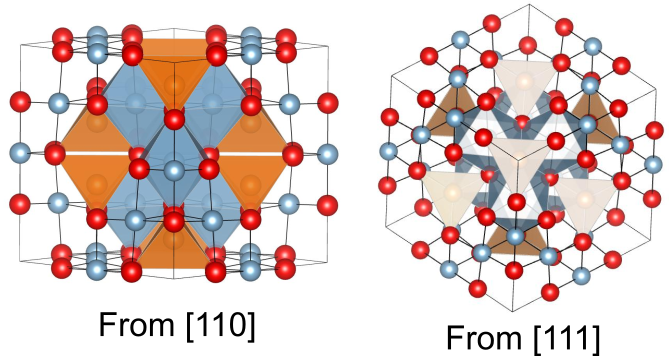
以上のようにスピネル構造を記述することができますが、実際に三次元的な結晶構造を自分で描写してみないと頭の中でイメージするのは難しいです.参考のため、異なる方向から見たスピネル構造を以下に示しておきます.
スピネル構造を持つ物質
スピネル構造は、四面体と八面体が頂点共有により三次元的なネットワークを形成しています.四面体内の金属はダイヤモンド構造、八面体内の金属はパイロクロア構造をそれぞれ形成します.
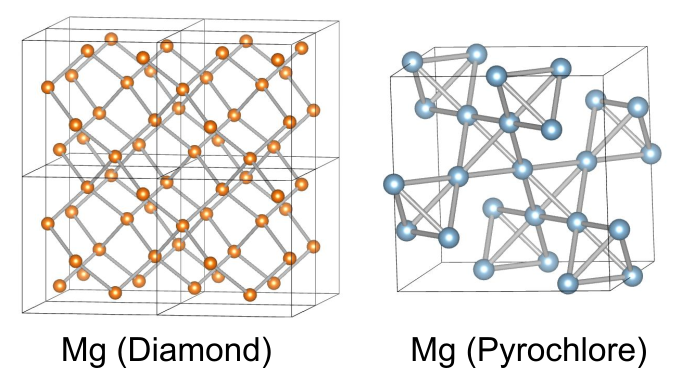
どちらも磁性の分野では有名な構造であり、実際にスピネル構造を持つ物質には磁気フラストレーション分野で注目されている物質が多数存在します.また、のネットワークだけに注目すると、立方晶ラーベス合金の構造をとっています.
スピネル構造を持つ物質の多くは酸化物ですが、その場合、金属の価数の選択肢としてはや
が存在します.
金属が4価以上の価数をとることができないので、4+以上の価数になりやすい4d,5dの遷移金属でスピネル構造となることは稀です.
酸化物の四面体サイトと八面体サイトでは、通常八面体サイトの方が大きな金属を収容できますが、スピネル構造では例外的に四面体のほうが大きい場合があります.
一方で、四面体サイトに小さな金属イオンが入る場合もあり、その場合はのような価数のバランスとなります.このような場合を逆スピネルと呼びます.
以下では、スピネル構造をとる代表的な物質を紹介します.
Fe3O4
天然の磁鉄鉱(マグネタイト)として産出し、磁石の性質を示します.人類が最初に見出した磁石であるとされます.また、還元することで得られる鉄の原料としても知られます.
逆スピネルであり、の価数分布を持ちます.
120 K付近でフェルベー転移と呼ばれる金属絶縁体転移を示しますが、長らくその起源は謎でした.最近の研究で、は低温でトリメロン(Trimeron)と呼ばれる電荷の秩序構造を持つことが明らかにされました.[a]
LiTi2O4
スピネル構造を持つ酸化物としてはじめて超伝導を示すことが明らかにされた物質です.超伝導体の中でも、13 Kという比較的高い転移温度を持ちます.また、電池材料の候補としても知られています.[b]
LiV2O4
重い電子系物質とは、通常の電子とは比較にならない程度に有効質量が大きい電子を持つような伝導性物質です.通常は、f電子を含む系などで見られますが、は3d金属を持つ酸化物の中で例外的に重い電子系の挙動を示す酸化物です.
がパイロクロア格子を組み、磁気フラストレーションの影響によりこのような挙動が見られると解釈されています.[c]
LiMn2O4
は、リチウムイオン電池の正極材料として注目されています.
は電気伝導性と
イオン伝導性を両立しており、代表的な正極材料である
よりも良好な充放電特性とサイクル特性を示します.[d]
また、は
よりも2桁ほど安いため、
は工業的な利用に適しています.
FeCr2S4
磁場をかけたときに電気抵抗が変化する現象を磁気抵抗効果と呼び、中には数万倍の電気抵抗変化を示す超巨大磁気抵抗物質が僅かに存在します.は、スピネルの中で初めて超巨大磁気抵抗効果が見出された物質です.[e]
スピネル構造の関連構造
スピネル構造はすでに複雑な構造ですが、金属サイトを2種類の金属で占有させるなどの方法で新しい結晶構造が現れます.
ハイパーカゴメ
スピネル構造において、パイロクロア構造を形成する金属を3:1の割合で異なる金属で規則的に占有することを考えます.このとき、金属の秩序パターンによって2種類の結晶構造が得られます.
一方はなどに見られる結晶構造で、
金属は正三角形が三次元的に頂点を共有したネットワークを持ちます.このような格子はハイパーカゴメ格子と呼ばれます.
はスピン液体の候補として知られています.[f]
もう一方は、金属がカゴメ格子状に並んだ結晶構造で、
やハーバトスミサイト
などで見られます.いずれも磁気フラストレーションの舞台として有名です.
ブリージングパイロクロア
スピネル構造において、サイトの金属を大きさの異なる金属で1:1に秩序化させる場合を考えます.このとき、
金属の大きさによって
金属周りの八面体の大きさが異なるようになり、このような場合の
金属の格子をブリージングパイロクロア格子と呼びます.
や
などで見られます.[g]
立方晶ラーベス合金
スピネル構造から酸素を完全に取り除くと、立方晶ラーベス合金の結晶構造となります.ラーベス合金は様々な物性を示しますが、超伝導や磁気熱量効果を示す物質が主に知られています.
まとめ
成り立ちを見てみれば比較的単純とはいえ、スピネルの結晶構造を頭の中で噛み砕いて理解するのはなかなか難しいです.
有名なマグネタイトに見られることから比較的ポピュラーな結晶構造であり、多くの分野で顔を出します.最近では、電池材料と磁性材料での研究が目覚ましいでしょうか.
特に、ダイヤモンド構造とパイロクロア構造の2つの顔を持つことから、磁気フラストレーションの舞台として注目されます.三元系結晶構造の代表格であり、今後も多くの研究対象となることが予想されます.
参考文献
[a] Nature, 2012, 481.7380: 173-176.
[b] Journal of the American Ceramic Society, 1999, 82.12: 3317-3320.
[c] Physical review letters, 1997, 78.19: 3729.
[d] Materials Research Bulletin, 1984, 19.2: 179-187.
[e] Nature, 1997, 386.6621: 156-159.
[f] Physical review letters, 2007, 99.13: 137207.
[g] Physical review letters, 2013, 110.9: 097203.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).