更新 2024-2-24
ヤーン・テラー効果(ヤーンテラー効果、Jahn–Teller effect)
配位構造とエネルギー
酸化物中では、正の電荷を持つ金属が負の電荷を持つ酸素イオンによって配位されています.酸化物において物性(磁性、電気伝導性、色など)の主役を担うのは主に金属イオンであり、物質の性質もまた金属の配位構造に強い影響を受けます.
酸化物でよく見られる配位構造は八面体配位や四面体配位ですが、このような配位の違いによって何が変わるのでしょうか.
金属イオンはd軌道に電子を持っています.d電子は5つの異なる軌道に収納され、金属イオンごとに異なる電子数を持ちます.配位子のない状態では5つの軌道は互いにエネルギーが等しい(縮退している)ですが、配位子があるとエネルギー分裂を起こします.
d軌道がどのように分裂し、電子がどのように分布するかは結晶場理論(配位子場理論)によって説明されるのでした.八面体配位の場合、d軌道はエネルギーの低い軌道(三重縮退)とエネルギーの高い
軌道(二重縮退)に分裂します.四面体配位の場合はエネルギーの序列が逆になります.
軌道と
軌道の間のエネルギー差を
、電子対生成エネルギー
を考慮し、そのエネルギーの兼ね合いによって電子がどの軌道を占有するのかが決まるのでした.電子配置のうち、全スピン数が大きな配置は高スピン、小さい方の配置は低スピンと呼ばれます.
前の記事では理想的な八面体配位や四面体配位だけを扱いました.しかし、世の中には理想的な状況だけではなく、構造的に歪んだ八面体や四面体が見られるケースもあります.
これは幾何学的な問題、すなわち原子が入り組んでいて理想的な多面体配位をとる十分なスペースがないという状況で起こりえます.それとは別に、金属イオンがある特定の数のd電子を持つ場合にのみ特異的に多面体が歪む場合があります.
このような現象の一つがヤーン・テラー効果(Jahn–Teller effect)です.物質の性質・結晶構造を考える上で極めて重要な概念です.この効果は1937年にHermann Arthur JahnとEdward Tellerによって導入されました.
八面体配位の場合
典型的な例として、金属イオンが酸素に八面体配位された酸化物を考えます.ペロブスカイト構造やスピネル構造など、固体酸化物の多くで見られる状況です.xyz軸を考え、配位子を各軸の上に配置します.
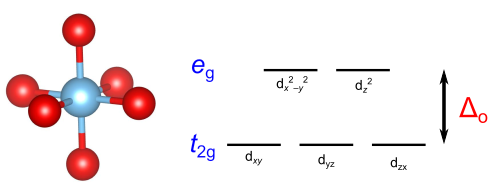
5重に縮退した金属イオンのd軌道は、配位子の影響により軌道(
と
と
軌道に由来)と
軌道(
と
軌道に由来)に分裂します.前者のほうが配位子との静電反発が少なくエネルギーが下にあり、後者は静電反発が大きいためエネルギー的に高くなります.
軌道と
軌道の間のエネルギー差を
と表します.
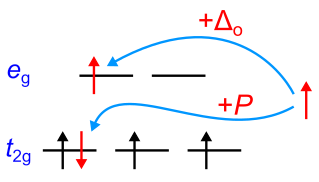
金属イオンのd電子は、エネルギーの低い軌道(軌道)から順番に占有していくのでした.フントの規則により、異なる軌道に入る電子はそれぞれスピンを平行に配置します.1つ、2つ、3つと電子を
軌道に入れていきますが、4つ目のd電子は、
軌道に既に占有している電子と反対方向のスピンを持って入れるか、あるいは
軌道に入れるかの選択肢があります.
ここでは、すでに占有されている軌道に2個目の電子を入れるために必要なエネルギー(電子対生成エネルギー)を考慮します.
ならば
軌道に入り、
ならば
軌道を空けて
軌道に4つ目の電子が入ります.全スピン数の大きさを考慮し、前者のケースをハイスピン(高スピン)、後者のケースをロースピン(低スピン)と呼びます.
電子数とヤーン・テラー効果
d4・高スピンの電子配置について考えます.ここでは、2つの軌道のうち1つのみが占有されています.この軌道は
軌道か
軌道のどちらかですが、もし前者であった場合はz方向にある配位子の結合電子と
軌道にある電子が強いクーロン反発を受けます.この際、配位子がz軸方向に伸びることによってクーロン反発を抑えようとし、結果として一方向に伸びた八面体が生成します.
これにより軌道が安定化されるとともに、全体のエネルギーが低下します.
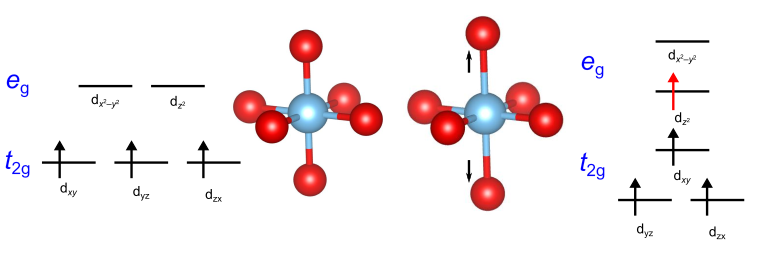
このような効果は、ヤーン・テラー効果として知られています.
一方、電子が軌道を占めていた場合はxy軸方向に強い反発を受けるため、z軸を伸ばす代わりにxy軸方向を伸ばす効果も考えられます.しかし、4つの結合を伸ばすよりも2つの結合を伸ばすほうが必要な力が小さいため、前者のように一方向のみを引き伸ばすような変形が起こる場合が多いです.
続いて、d9の電子配置を考えます.ここでは高スピン・低スピンの区別はなく、軌道は6つの電子で埋まり、
軌道には3つの電子があります.考えられる配置としては、
軌道に2つの電子と
軌道に1つの電子があるパターン、および
軌道に2つの電子と
軌道に1つの電子があるパターンです.
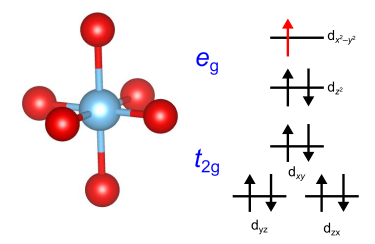
前者の配置ではxy軸方向の4つの配位子を引き離すことで、後者ではz軸方向の2つの配位子を引き離すことでエネルギー的な利得があります.やはり2つの配位子を引き離すほうが容易なので、d9の電子配置では軌道が安定化され、
軌道に一つだけ電子のある配置が実現する場合がほとんどです.
銅は2価(d9)をとることが多く、ヤーン・テラー効果によって一方向に伸長した八面体が現れます.高温超伝導帯で有名な銅酸化物でよく見られます.中には例外として、z軸方向だけが縮んだ物質()も知られています.[a]
ヤーン・テラー効果は格子の変形を伴い、格子の変形はエネルギーの上昇を伴います(歪みエネルギー).実際の物質では、ヤーン・テラー効果によるエネルギー利得と格子変形によるエネルギー上昇の兼ね合いで変形の度合いが決まります.このため、ヤーン・テラー効果を示すはずの電子配置にも関わらず、見た目には変形が観測できないケースもあります.
正方形配位の場合
また、平面四配位(正方形配位)はz軸方向の配位子が無限の彼方に去ってしまったヤーン・テラー効果の究極体とみなすことができ、やはり2価(d9)の銅イオンを含む銅酸化物でよく見られます.
1価のニッケルもd9の電子配置を取り、平面四配位をもつや
などの物質が報告されています.これらのニッケル酸化物も超伝導を示すことが最近報告されました.一方で、ヤーン・テラー効果を示さない電子配置であるFe2+でも平面四配位が見られるケースもあります.[b,c]
その他、低スピンのd7配置でもヤーン・テラー効果が見られます.d1やd2でもヤーン・テラー効果がは起こるはずですが一般にその効果はわずかです.それは、軌道に対して配位子を遠ざけたときの効果が小さいことに由来します.
はV3+(d2)に対し、Hがトランス位にある八面体配位(平面四配位と同じ対称性)を持ちますが、その要因はヤーン・テラー効果に基づくものとされます.[d]
一方で、ヤーン・テラー効果を全く示さない電子配置もあります.d0,d3,d5,d8,d10では八面体の変形によるエネルギーの利得がないため、一般にヤーン・テラー効果を示しません.
四面体配位の場合
四面体配位の場合、と
と
軌道(
軌道)が
と
軌道(
軌道)よりもエネルギー的に高くなるのでした.また、八面体配位のケースよりも分裂のエネルギー
が小さくなることが知られています.四面体配位では高スピンをとる場合が多いです.
軌道の一部に電子が占有している場合にヤーン・テラー効果を示す場合があります.d4配置やd9配置の場合、ヤーン・テラー効果によって四面体は上から押しつぶされたような平坦な形となります.d3やd8配位の場合は、縦に引き伸ばしたような細長い四面体となります.八面体のときと比べると変形の駆動力が小さく、必ずしも予測される通りの変形をするとは限りません.
まとめ
ヤーン・テラー効果は多くの電子配置で起こる普遍的な現象です.結晶構造を眺めてみて、いやに多面体が歪んでいる場合はヤーン・テラー効果の影響を考えるのが第一です.特に、銅やマンガンはヤーン・テラー活性な電子配置を取ることが多いです.
物性にも影響を与え、銅酸化物やニッケル酸化物における超伝導は、ヤーン・テラー効果によって平面四配位が安定化されることに関係しているとされています(されているはずです).
参考文献
U. Müller, Inorganic Structural Chemistry (Wiley, 2007).
[a] Proceedings of the National Academy of Sciences, 2019, 116.25: 12156-12160.
[b] Journal of the American Chemical Society, 1999, 121.38: 8843-8854.
[c] Nature, 2007, 450.7172: 1062-1065.
[d] Angewandte Chemie International Edition, 2014, 53.29: 7556-7559.
結晶構造の描画にはVESTAを使用.K. Momma and F. Izumi, "VESTA 3 for three-dimensional visualization of crystal, volumetric and morphology data," J. Appl. Crystallogr., 44, 1272-1276 (2011).