更新 2024-2-28
色素増感太陽電池(光増感太陽電池、dye-sensitized solar cell、DSC、DSSC)
宇宙から降り注ぐ太陽光線は、少なくとも10億年は利用可能なエネルギー源です.膨大なエネルギーのうちの0.1%でも有効に利用できれば、エネルギー消費量の跳ね上がった現代文明でさえも賄うことの可能な圧倒的な物量があります.
これほど巨大なエネルギーを利用しない手はありません.太陽光線を浴びてスクスクと育つ植物に負けている場合ではなく、人類も太陽エネルギーの有効な利用法を確立しつつあります.太陽電池は、まさにその最たる例です.
20世紀中期に太陽電池が発明されてから小型化・高性能化が進み、卓上の電卓や時計、屋根の上のソーラーパネルなど日常生活で見かける機会も増えてきました.生活で見かける太陽電池のほとんどはシリコンを用いたものです.
シリコンは地球上に豊富で安価な元素ですが、高性能な太陽電池には超高純度のシリコンが求められ、値段も相応に高くなります.また、製造には高価な半導体設備が必要で、簡単にはアクセスができません.
この先、再生可能エネルギーへの期待から太陽電池の需要がますます大きくなることを考えると、なるべく安価かつ簡便に製造可能な太陽電池の開発が急務となっています.こうした要請の後押しもあり、シリコン太陽電池に代わる太陽電池を目指して、開発研究が進められています.
今回の記事の主役となる色素増感型太陽電池は、シリコン太陽電池とは大きく異なる発電メカニズムに基づきます.化学反応を利用し、安価・簡便な製造が可能ですが、安定性や発電効率にはまだ課題が残されています.
今回は、色素増感太陽電池の歴史と仕組み、課題について見ていきます.
色素増感太陽電池
従来の太陽電池は、半導体のpn接合を利用した物理デバイスでした.
接合部分に光を当てることで電子にエネルギーが与えられ、電子と電子の抜け穴(正孔)が生成します.あらかじめ設計された通り道に沿って電子と正孔が逆方向に移動し、電力が取り出されます.
半導体の色素増感による太陽電池の歴史は古く、1971年にはクロロフィルの吸着した酸化亜鉛を用いた光増感太陽電池の報告があります.
しばらくは変換効率が低く、実用化とまではいきませんでしたが、1991年にスイスのGrätzelらの報告がきっかけとなり、世界中で実用化を目指した研究が進められるようになりました.その名を冠し、Grätzelセルという呼び方もされます.
色素増感太陽電池でも半導体を用いるという点では従来の太陽電池と共通していますが、化学反応を用いるという点と色素分子を用いる点で従来のものと大きく異なります.全体像はかなり複雑ですが、一つずつのパーツの役割を以下で見ていきます.
主流の色素増感太陽電池では、半導体材料の酸化チタン()を用います.
は光触媒としてよく知られる材料です.
に紫外光を照射することで物質内部に電子と正孔が生まれ、電気伝導性を示すとともに水や有機分子の酸化分解が可能となります.
この電子と正孔を発電に利用できないかという発想が、色素増感太陽電池の出発点です.は電子の移動速度が大きく、光を利用した電気化学反応に適していますが、紫外光以上のエネルギーを持った光しか吸収できないという弱点があります.
太陽光に含まれる光はほとんどが紫外光よりエネルギーの低い可視光・赤外光であり、豊富なこれらの光をは利用できません.そのため、
を太陽電池に用いても発電効率はごく小さなものとなります.
が紫外光しか吸収できないのであれば、可視光も吸収できるようにすればいいじゃない.色素増感太陽電池では、
の表面に色素を吸着させることで、可視光の吸収を可能にします.
色素は可視光を吸収し、エネルギーの高まった電子をに受け渡し、そのまま電極に電子が移動します.電極には、電気を流しながらも光が透過する材料として透明導電体が使用されます.
電子はに渡されますが、色素には対となる正孔が残されます.すなわち、色素は酸化された状態となっています.太陽電池が機能するには、この正孔を反対側の電極に受け渡す必要があります.
色素が吸着されたは電解液に接しており、電解液にはヨウ化物イオン(
)が含まれています.酸化された色素は、電解液中のヨウ化物イオンから電子を受け取ることで元の状態に戻ります.それと引き換えに、ヨウ化物イオンは還元されて三ヨウ化物イオン(
)となりますが、これは対電極へ移動して電子を受け取り、ヨウ化物イオンに戻ります.

以上のように、
(1)色素による電子の吸収、
(2)色素→→電極への電子の移動、
(3)色素→酸化還元対→電極への正孔の移動
によって電気回路がつながり、外部に電力を取り出すことが可能となります.色素による太陽光の吸収とそれに続く電子移動は、植物の光合成を彷彿とさせます.
このように、色素増感太陽電池は既存の太陽電池と大きく異なります.従来の太陽電池では、電荷の発生と輸送が同一の素材中で行われるのに対し、色素増感型では電荷を複数の物質間でせっせと輸送していきます.発電の過程で化学反応が起こるなど、複数のプロセスを組み合わせたデバイスであると言えます.
色素増感太陽電池は特別な設備を使うことなく製造が可能であり、特殊な半導体設備が必要な従来のシリコン太陽電池に対して優位性があります.一方で、変換効率や耐久性が劣るため、家庭用などへの実用化には課題がまだ残されています.
色素増感太陽電池の構成要素
(1)酸化チタン
電子輸送に利用するなどの酸化物は、ナノ粒子を用いた多孔質膜として使用します.これにより、表面積を可能な限り大きくし、効率的に反応を進めることが可能となります.
また、に吸着した色素に光が到達するように、電極には透明かつ電気を流す材料が使用されます.
(2)色素分子
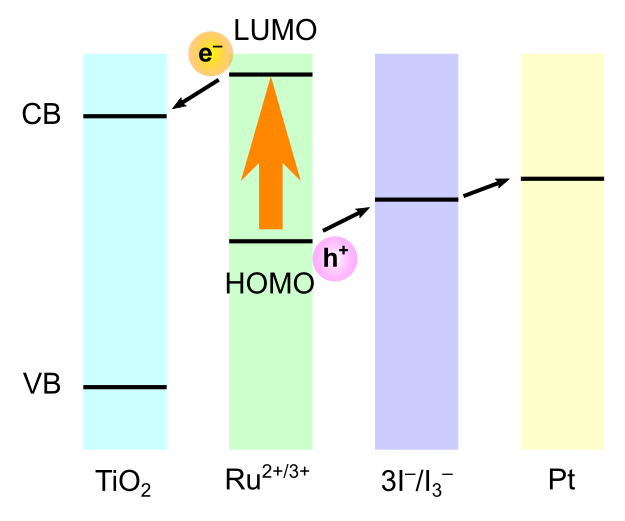
可視光を吸収し、電子をに受け渡す役割を担います.どんな色素でも利用できるわけではなく、エネルギー準位に一定の条件が必要となります.
に電子を渡すために、色素の励起準位(LUMO)は
の伝導バンド下端よりも上部に位置する必要があります.また、正孔を渡さないために、基底準位(HOMO)は
の価電子バンドの上端よりも上部に位置しなくてはなりません.
このような条件を満たす分子として、Ru錯体が使用されます.カルボキシル基を持つ錯体を使用することで、への吸着性を高めることが可能です.
色素の電子が励起した状態は不安定であり、すぐに元の状態に戻ろうとします.そうなる前に電子をに受け渡すために、色素層は可能な限り薄くする必要があります.その分、光の吸収量は減ってしまうわけですが、
の表面積を大きくすることで補います.
(3)電解液
電子をに受け渡した色素は酸化状態となります.酸化状態の分子は電子を欲するので、このままでは
から電子が戻ってきてしまう場合があります.これを避けるためには、酸化された状態の色素を還元する必要があり、電解液に含まれる
がその役割を担います.
まとめ
太陽光を効率的に利用する上で、シリコン型太陽電池以外の太陽電池の開発を進めることは重要です.色素増感太陽電池は、安価かつ簡便に製造が可能で、色素や酸化物の組み合わせによって多彩な種類のセルを組むことが可能です.最も重要な変換効率は日進月歩で、年ごとに着々と向上しています.効率はシリコン型に及ばずとも、異なるフィールドでの実用化が期待できます.
また、後発のペロブスカイト太陽電池は色素増感太陽電池を基礎にしていますが、近年の爆発的な研究によって変換効率が大幅に向上し、シリコン型のものに迫ろうとしています.
参考文献
化学と教育 2008 年 56 巻 3 号 p. 120-121
化学と教育 2013 年 61 巻 5 号 p. 224-227
化学と教育 2017 年 65 巻 7 号 p. 352-355
日本エネルギー学会機関誌えねるみくす 2017 年 96 巻 2 号 p. 163-171
シャープ技報 第100号・2010年2月
Best Research-Cell Efficiency Chart | Photovoltaic Research | NREL