ホール・エルー法(Hall-Héroult process)
アルミニウムといえば、地殻中で酸素とケイ素に次いで豊富な元素であり、アルミホイルや一円玉としてよく見慣れた金属です.軽量性・耐熱性・熱伝導性に優れることから日用品から構造材料に至るまであらゆる場所で見かけ、安価な金属の代表格として第一に思い浮かぶ程度にはありふれた存在と化しています.
しかし、アルミニウムが安価な金属となったのは、人類の歴史から見ればごく最近の話です.

アルミニウムは地球上で例外なく酸化物の形で産出しますが、この酸化物(アルミナなど) は非常に安定であり、生半可な力では純粋なアルミニウムを得ることはできません.そのため、長らくアルミニウムは手にするのが非常に困難な金属の代表格であり、かつては金や銀よりも高価でした.*1
そのような状況が変わったのは、アルミニウムを安価に得ることのできる手法が確立されたため他なりません.
1886年に二人の科学者が独立に発明した電解プロセスは、アルミニウムの未来を永遠に変えてしまいました.このホール・エルー法は、電気の力でアルミナから純粋なアルミニウムを作り出します.100年以上前に編み出された手法でありながら、形を変えながら現在でもアルミニウムの精錬方法として使われ続けています.
では、ホール・エルー法とはどのような経緯で生まれ、どのような原理によってアルミニウムを生み出すのでしょうか.

ホール・エルー法の歴史
イオン化傾向から想像できるように、アルミニウムは反応性の高い金属です.そのため、自然界に産出するアルミニウムは200以上の鉱物に化合物として含まれています.ミョウバンはアルミニウムを含む代表的な材料であり、アルミニウムという名前はミョウバンのラテン名”Alumen”に由来します.
こうした化合物中から純粋なアルミニウムを取り出すための試みは19世紀頃に盛んになりました.ミョウバン石の電気分解や塩化アルミニウムへのアルカリ金属を用いた還元を経て純粋なアルミニウムを得ることに成功しましたが、工業的に製造可能な水準ではありませんでした.*2
1886年はアルミニウム製造において歴史的な年でした.フランスの Paul Heroult とアメリカのCharles Martin Hallは、独立に新しいアルミニウムの製造法の特許を取得しています. 両者ともに、氷晶石(クリオライト、)を主相とする溶融塩電解質中に溶解した酸化アルミニウム(
)を、カーボン電極を用いて精錬する手法です.この手法は発明者二人の名前をとり、Hall–Héroult法(ホール・エルー法)と呼ばれます.*3
ホール・エルー法のプロセス
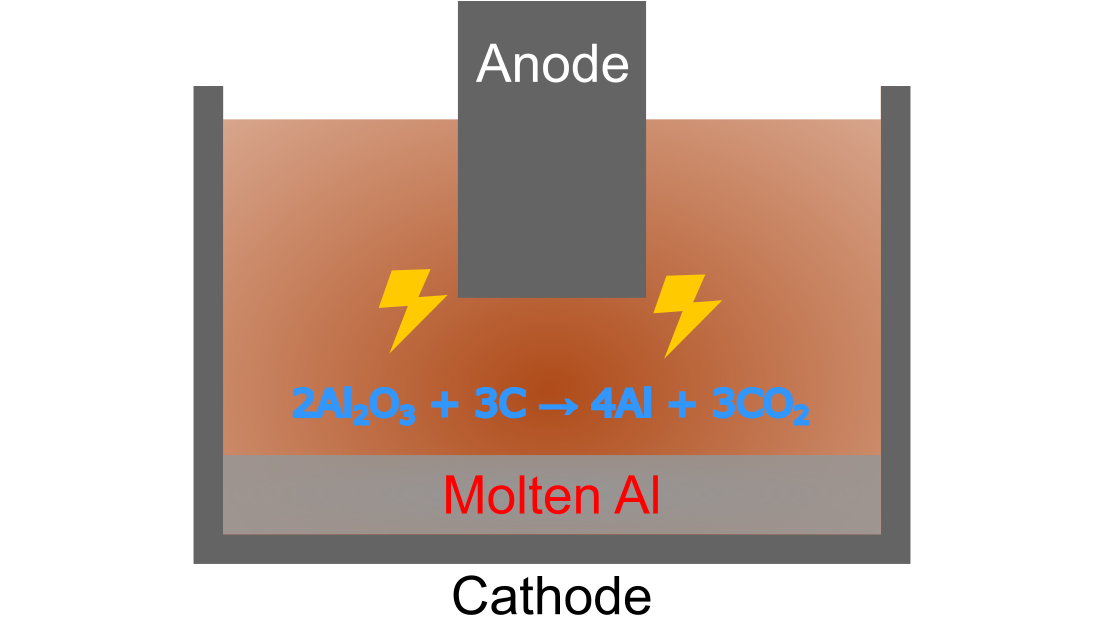
ホール・エルー法の肝は、溶融フッ化物浴中にアルミナを溶解させるという点です.このうちアルミナは、1887年に開発されたバイヤー法によって安価で得られるようになり、ホール・エルー法の工業化にとって追い風となりました.バイヤー法は、天然に産出するボーキサイト*4から純粋なアルミナを得ることを可能にしました. バイヤー法については記事を改めて紹介します.
バイヤー法によって得られたアルミナは、溶融した氷晶石に溶解させ、電気分解によってアルミニウムを得ます.原理だけ見ると非常にシンプルであり、全体の反応は以下のように表されます.
なぜこれほどシンプルな反応が19世紀後半まで実現できなかったのでしょう.
電気分解を行うには、なんとかしてアルミナの溶液を作る必要があるのですが、融点が 2054℃と非常に高いために融解させるのは現実的ではありません.アルミナはそのままの状態では水に溶けませんが、などの強塩基を加えるとアルミニウムの水溶液を得られます.しかし、この水溶液を電気分解しようとすると、水素イオンが先に還元されてしまい、目的のアルミニウムは得られません.*5
ホール・エルー法では、融点が1010℃の氷晶石 () の溶融塩にアルミナを溶解させて電気分解を行います.氷晶石は、天然に存在する鉱石の中で最もフッ素含有量が多いことで知られ、アルミニウムの精錬に使用するうえで多くのメリットを有しています.
すなわち、アルミナの溶解度が大きく、融点が比較的低く、電気伝導度が大きく、溶融状態で長時間安定であり、アルミニウムの溶解度が小さく、密度が小さいという点です.実際には、これらのメリットを際立たせるためにナトリウムとアルミニウムの比率を調整して使用されます.*6
こうして溶解させたアルミナの溶液に強力な直流電流を流すと、溶融アルミニウムが浴槽の底に残り、アルミナ中の酸素が炭素電極と反応して二酸化炭素を形成します.各電極での反応は以下のように表されます.
(カソード)
この反応に必要な理論エネルギーは温度によって異なり、例えば1000 Kでは635 kJ (1.1 V)です.しかし、実際には過電圧の影響により4 Vほどの電圧が必要になります.
アノード電極である炭素は二酸化炭素となって消耗するので、都度補充する必要があります.カソード電極にも炭素が使用されますが、こちらは反応に関与しないので消耗しません.しかし、劣化はするのでメンテナンスは必要です.
生成したアルミニウムの密度は氷晶石よりも小さいため、通常、アルミニウムは溶液の下に沈みます.そのため、アルミニウムの析出するカソードは溶液の下側に取り付けられます.
アルミナの電気分解には1 tのアルミニウム生成あたり12000~15000 kWhという莫大な電力が必要です.それゆえアルミニウムの生産には、電気エネルギーが豊富で電気代の安い国であるほど有利であり、この条件に反する日本では2014年以降アルミニウムの精錬事業は行われていません.それでもホール・エルー法以前に行われていたアルミニウムの精錬方法に比べると画期的に効率が良いことは確かです.
まとめ
今では当たり前のように使用されるアルミニウムですが、かつては金や銀を超えるほど高価な金属でした.しかし、原料であるボーキサイトの採掘、バイヤー法によるアルミナの製造、 そしてホール・エルー法によるアルミニウムの精錬方法の確立によって現在のように安価な金属となりました.
かつては高価で庶民の憧れであったにもかかわらず、現在では誰にでも手が届くようになったものは多くありますが、その背後には技術のブレークスルーとその確立に向けた泥臭い積み重ねがあることは覚えておきたいところです.
参考文献
"125 years of the Hall Héroult Process What Made It a Success?," Molten salts chemistry and technology (2014): 103-112.
"Aluminium production process: from Hall Héroult to modern smelters." Chem Texts 8.2 (2022): 10.
まてりあ Materia Japan 第60巻第7号(2021)
Production of aluminum metal 1989 Volume 39 Issue 5 Pages 403-414
Electrolytic Smelting of Aluminum 1980 Volume 30 Issue 2 Pages 111-117