更新 2024-2-23
電気化学反応の用語
電気化学反応には大きく二種類あります.
一つは電池.物質の持つ化学エネルギーを電気エネルギーに変換して使用します.もう一つは電気分解.自発的には起こらない化学反応を電気エネルギーによって起こします.その他、光や熱を用いた反応もありますが、大枠は変わりません.
こうした反応を考えるにあたって、問題となるのは用語です.
正極と負極、アノードとカソードは電池と電気分解どちらにも登場する用語ですが、何を指すかを理解していますか?
正極と負極、アノードとカソード、陽極と陰極
まずは実際の反応系の例を見てみましょう.
いずれにおいても外部回路で接続された一対の電極(電子伝導体)が電解質(イオン伝導体)によって分断されています.電解質は各電極のある部屋ごとに仕切られている場合が多いです.
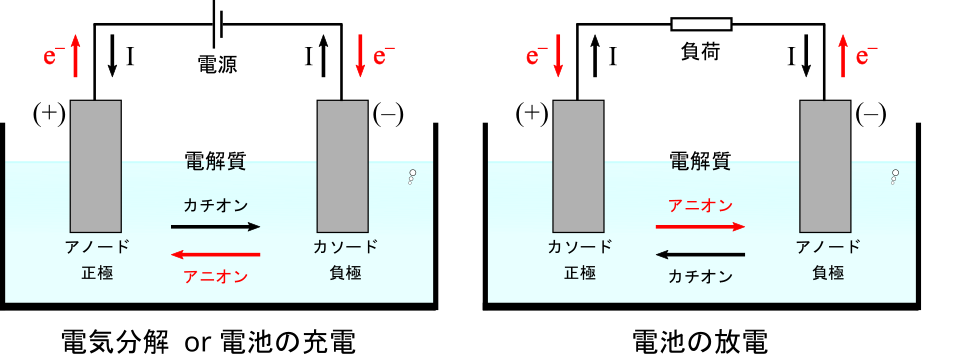
アノードとカソード(Anode and Cathode)
アノード・カソードは起こる反応に着目した分類です.
酸化反応が起こるほうがアノードであり、ギリシャ語で上り坂を意味します.
アノード(Anode)に向かって移動するイオンがアニオン(Anion)です.
還元反応が起こるほうがカソードであり、ギリシャ語で下り坂を意味します.
カソード(Cathode)に向かって移動するイオンがカチオン(Cation)です.
アノード:
カソード:
正極と負極
正極・負極は電位に着目した分類です.
電位が高い方(プラス)が正極、低い方(マイナス)が負極です.
電流は電位の高い方から低い方へ流れ、反対に電子は電位の低い方から高い方へ流れます.
陰極と陽極
陰極・陽極は中学・高校で習う概念ですが、(たちの悪いことに)いくつかの流派があり定義が定まっていません.
例えば、「Weblio辞書」で「陰極」のページを見てみましょう
デジタル大辞泉では、以下のように書かれています.
「対となる二つの電極のうち、電位の低いほうの電極。負の電極。負極。マイナス極。⇔陽極。」
ゆえに、負極と陰極は同じということのようです.
一方、電気化学用語集では以下のように記述されます.
「カソードともいう。電気化学的還元反応が起きる状態にある電極。」
すなわち、陰極はカソードと同じ意味のようです.
つまり、陰極=負極=カソード?
残念ながら負極とカソードは全く別の概念です.以下で見ていくように電池の充電・放電や電気分解において負極とカソードは別の電極を指しています.
このような混乱の状況は1952年に刊行された技術資料でも指摘されています.[a,b]
実際に陽極・陰極という用語が使用されるときはどのような場合でしょうか.電気分解反応では電位の高低で陽極・陰極を区別します.ゆえに、電気分解では陽極=正極、陰極=負極.
一方、電池反応では電子が流れ出すか流れ着くかで区別します.ゆえに、電池反応ではカソード=陽極、アノード=陰極.
ややこしいわ!
現在のところ「アノード・カソード」と「正極・負極」の概念だけで事足りるので、「陽極・陰極」のワードはいらないんじゃないかと思います.
結果として、いずれの反応においても「正極=陽極」、「負極=陰極」となるのでそのように覚えてしまって良いかもしれません.
具体例
以上をもとに、具体的な例をもとに見ていきましょう.
ダニエル電池
ダニエル電池は極と
極から構成され、以下の2種類の反応が起こります.
(1)
(2)
(1)ではが電子を失っているので酸化反応です.そのため、
極の方がアノードとなります.
また、極で電子が生成して
極の方へ向かっているので、電位は
極が負、
極が正です.それゆえ、
極が負極、
極が正極です.

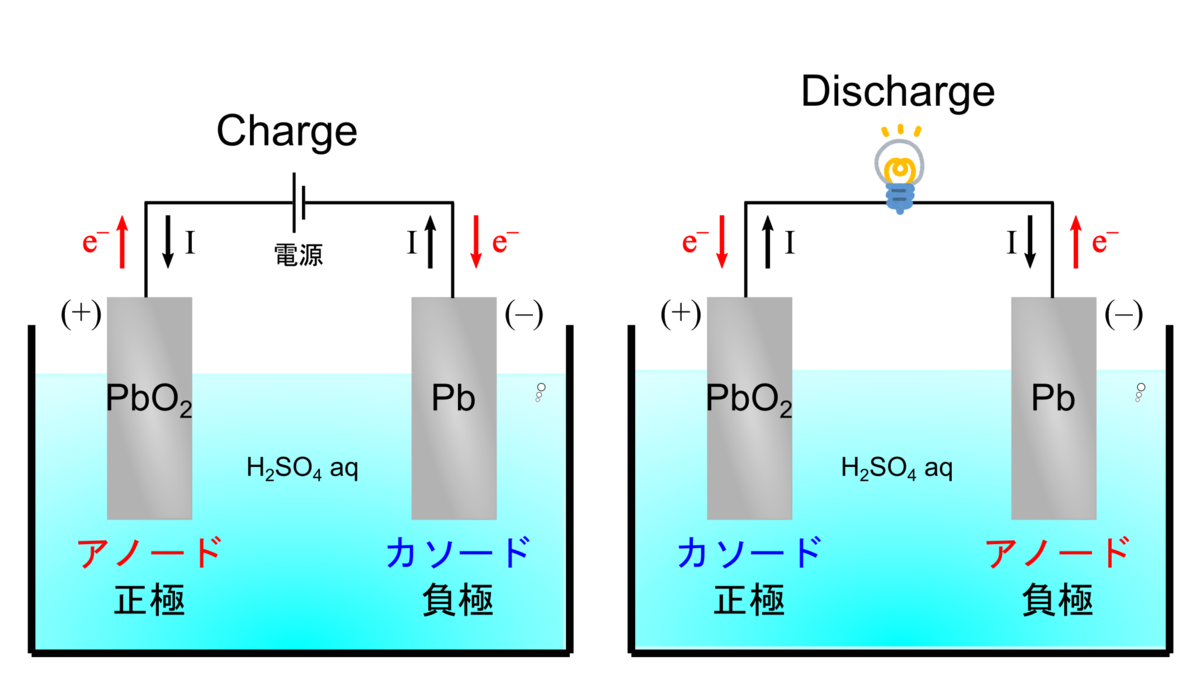
鉛蓄電池
二次電池である鉛蓄電池では放電と充電で逆の反応が起こります.電池は極と
極から構成されます.
放電反応
(1)
(2)
ダニエル電池と同様の考え方により、極がアノードであり負極です.
極がカソードであり正極です.
充電反応
(1’)
(2’)
充電反応では放電反応と逆の反応が起こります.
今度は極で還元反応が起こるので
極はカソードとなります.逆に、
極で酸化反応が起こるので
極はアノードです.
電子は極から
極に向かって流れますが、間に電源が挟まるので電位は
極の方が高いです.ゆえに、
極が正極、
極が負極です.
放電反応と比べると、アノードとカソードは入れ替わり、正極と負極は変わりません.
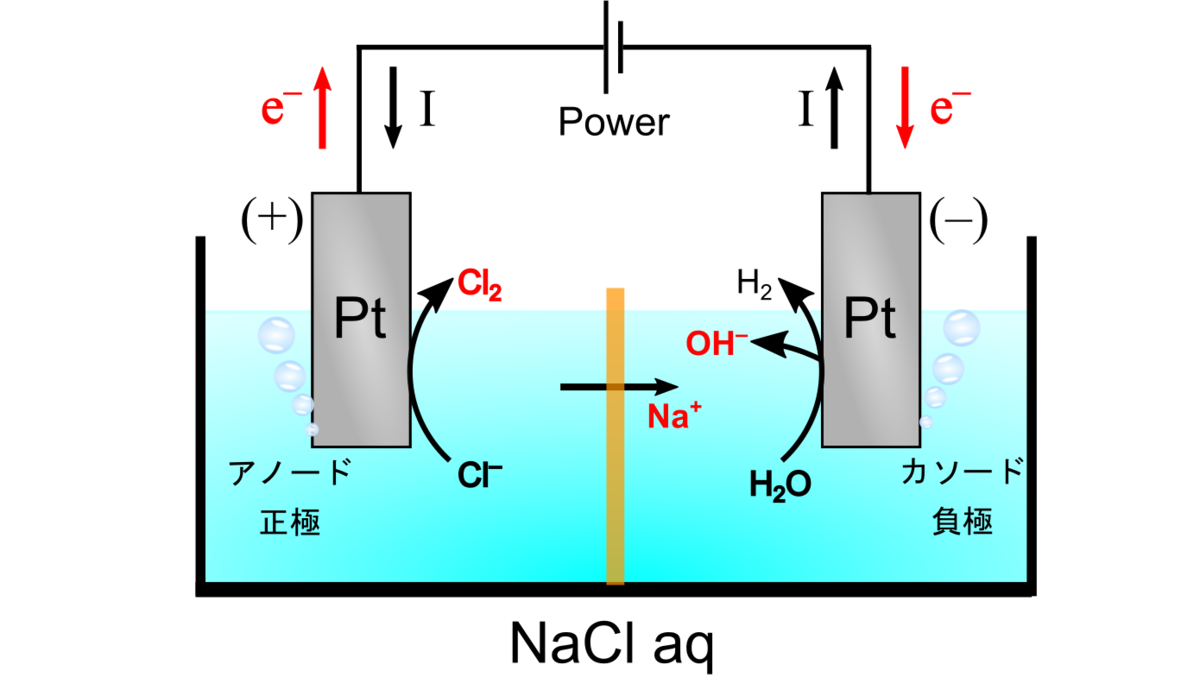
塩水の電気分解
最後に電気分解反応を見ていきます.といっても、起こっていることは電池の充電反応と同じことです.
(1)
(2)
(1)がカソード、(2)がアノードです.かつ、(1)が負極、(2)が正極です.
まとめ
以上をまとめると以下のようになります.
電池放電:アノード=負極=陰極、カソード=正極=陽極
電池充電:アノード=正極=陽極、カソード=負極=陰極
電気分解:アノード=正極=陽極、カソード=負極=陰極
ややこしいですが、図を書いて整理するとおぼえやすくなります.