更新 2024-2-23
電気分解(electrolysis)
電気分解は「電気のエネルギーによって強制的に酸化還元反応を起こすこと」を意味します.英語では、”electrolysis”.electro-(電気)を-lysis(分解)でそのままです.
電気分解は、水の電気分解による水素発生反応を筆頭に、塩素の単離、NaOHの製造、金属メッキ、金属の精錬など、産業の幅広い分野に顔を出します.電池の充電反応も電気分解の一種です.
電気「分解」と名は付きますが、分解のイメージにそぐわない応用も多く、専門家の間では「モノを壊す」イメージから脱局するために「電解」の呼称を用いる場合もあるとかないとか.
電気分解の反応(例:水酸化ナトリウム水溶液の電気分解)
電気分解に必要なものは、二本の電極と外部電源、そして電気分解したい物質(多くは溶液)です.ただし、溶液はイオンを含むような物質である必要があります.食塩水や塩酸でOKです.
溶液に電極を二本挿し、外部電源から直流電圧をかけると何が起こるでしょうか.
十分な電圧をかけると、電源のプラス極は物質中の電子を引き寄せて物質の外に出そうとします.これを酸化と呼びます.酸化の起きる電極をアノードと呼びます.一方、電源のマイナス極は物質中に電子を押し込もうとします.これを還元と呼びます.還元の起きる電極をカソードと呼びます.
電気分解では、外部電源の力を借りることで酸化・還元反応を無理やり進行させ、新しい物質を生成します.電圧や溶液、電極を変えることで反応種を制御し、望みの物質を電気分解から合成することができます.
水酸化ナトリウム水溶液の電気分解
具体的な例で考えてみましょう.
典型的な電気分解の模式図を示します.教科書でよく見るのは水()の電気分解なので、それに倣います.
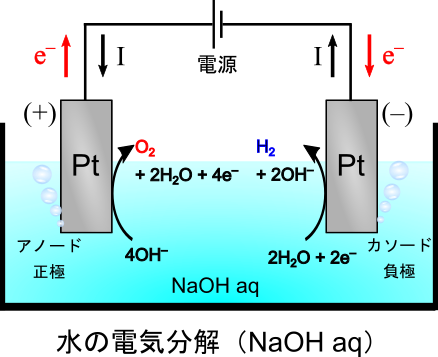
水を電気分解することにより、水素ガス()と酸素ガス(
)を取り出すことができます.教科書的な実験であるだけでなく、エネルギー材料である水素を生成する方法として工業的に使用されます.
ただし、純粋な水ではイオン濃度が極めて低いので、そのままでは電気を通しません.そのため、電気分解をするにあたって電解質を加える必要があります.今回は、水酸化ナトリウム()水溶液を使用することにします.
水の分解反応は以下の式で表されます.
この反応は吸熱的であり、自発的には起こりません.水がひとりでに酸素と水素に分解されることはないということです.
この反応を起こすには何らかのエネルギーを注入する必要があるのですが、電気分解では電気エネルギーによって無理やり反応を起こします.
実験装置のセッティング
先程述べた通り、用意するものは二本の電極と外部電源、そして電気分解したい物質(今回は水酸化ナトリウム水溶液)です.二本の電極では酸化反応と還元反応がそれぞれ起こります.
金属単体が還元されることは稀ですが、酸化反応は困りものです.電極が酸化されてしまっては困るので、酸化されにくいものを選びましょう.通常、白金や炭素の棒が使用されます.
材料を用意したので、装置を組み立てます.といっても二本の電極を溶液に浸すだけです.さて、現在の状況を確認してみます.
溶液中にある化学種は、水酸化ナトリウム由来のと
(水中なので完全に電離)、および水溶液由来の
です.あと、場合によっては電極も反応に寄与します.塩基性溶液なので、
はほとんど存在せず、反応に寄与しません.
電圧をかけた時、この中のどれかが酸化還元反応を起こします.どの化学種が酸化(還元)されるのかといえば、最も酸化(還元)されやすいものが反応します.
最も酸化(還元)されやすい化学種は、大雑把にはイオン化傾向を見て判断できます.
イオン化傾向には定量性がありませんから、標準電極電位の値を見るともっと信頼性が高いです.ラチマー図やフロスト図も理解の助けになります.
大雑把に言えば、反応式の化学種について、標準電極電位が負に大きければ酸化されやすく、正に大きければ還元されやすいといえます.
各化学種の反応の化学式と標準電極電位の値を見てみます.
では、それぞれの電極でどの反応が起こるかを確認します.
電源のプラス極につながったアノードでは酸化反応が起こります.
系にある物質()の中で、最も酸化されやすい化学種は何でしょうか.上式に従えば、最も酸化されやすいのは
ですので、酸化されて酸素が生成します.
電源のマイナス極につながったカソードでは還元反応が起こります.
同様に最も還元されやすい化学種はなので、還元されて水素が生成します.
このように、水酸化ナトリウム水溶液の電気分解からは水素と酸素が生成します.
標準電極電位の値から、水の分解には 1.23 V の電位差が必要なことが分かります.これ以下の電圧をかけても水の分解は進行しません.したがって電流も流れません.
電気分解の歴史
最後に、電気分解の歴史を振り返りましょう.
電気分解を行うには、有意な電圧を安定して発生させることのできる装置が必要となります.そのため、電気分解が可能になったのは電池が発明されてからです.
ボルタ電池の発明によって電圧の制御が可能になると、電気エネルギーを利用した化学反応への応用が盛んに行われました.
1800年に、Anthony Carlisle と William Nicholson によって初めて水の電気分解が達成されました.ボルタ電池が完成したのは同じく1800年のこと.驚くようなスピード感で電気分解の研究が進んでいることが分かります.
アルカリ金属やアルカリ土類金属は酸化されやすく、自然界ではカチオンとしてのみ存在しています.反対にハロゲンは還元されやすく、アニオンとしてのみ存在します.これらの単体を生成するにあたって、電気分解が大いに活用されました.
Humphry Davy 卿は、ボルタ電池を使った電気分解によって様々な元素を単離しました.カリウム、ナトリウム、バリウム、マグネシウムは全て Davy 卿によって発見されたものです.
1821年には、最も還元しにくい元素であるリチウムが William Thomas Brande により得られました.
その後、ファラデーの法則でお馴染みの Michael Faraday が、これらの反応を総称して電気分解(electrolysis)の名を与えました.
また、1886年にフッ素を単離したフランスの Ferdinand Frederick Henri Moissan は1906年のノーベル化学賞を受賞しています.
その後、ホール・エルー法によるアルミニウムの精錬をはじめ、電気分解は工業的に欠かせない手法として確立し現代に至ります.
まとめ
冒頭に述べたとおり電気分解の応用先は様々で、系によって関与する化学種も様々です.しかし、結局の原理は単純で「自然には起こらない反応を電気エネルギーで無理やり起こす」だけです.
ハロゲンガスの生成反応は「アニオン型状態が安定なハロゲンを、電気エネルギーで無理やり酸化して単体に戻す」、金属の精錬は「酸化物の状態が安定な金属(アルミニウム)を溶解させ、電気エネルギーで無理やり単体金属に戻す」、二次電池の充電は「そのままだと放電してしまう電池を、電気エネルギーで無理やり元の状態に戻す」という反応を行っているだけで、化学種は違えどやっていることは同じであると言えます.
参考文献
化学と教育 1996 年 44 巻 10 号 p. 656-659